
碱金属卤化物是典型的离子晶体,它们的晶格能与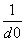 成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
| 晶格能/kJ·mol-1 | 离子半径/pm | |
| ① | LiF LiCl LiBr LiI 1 031 845 807 752 | Li+ Na+ K+ 60 95 133 |
| ② | NaF NaCl NaBr NaI 915777 740 693 | F- Cl- Br- I- 136 181 195 216 |
| ③ | KF KCl KBr KI 812 708 676 641 |
A.晶格能的大小与离子半径成正比
B.阳离子相同、阴离子不同的离子晶体,阴离子半径越大,晶格能越小
C.阳离子不同、阴离子相同的离子晶体,阳离子半径越小,晶格能越大
D.金属卤化物晶体中,晶格能越小,还原性越强
科目:高中化学 来源: 题型:
C和Si元素在化学中占有极其重要的地位。
(1)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为________,微粒间存在的作用力是________。
(2)氧化物MO的电子总数与SiC的相等,则M为________(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是_____________。
(3)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键_________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属能导电的原因是( )
A.金属晶体中金属阳离子与自由电子间的相互作用较弱
B.金属晶体中的自由电子在外加电场作用下发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
金属晶体的形成是因为晶体中存在( )
A.金属阴离子间的相互作用
B.金属原子间的相互作用
C.金属阳离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
将金属晶体的密堆积方式、对应的晶胞、配位数及其实例进行连线。
密堆积方式 对应的晶胞 配位数 实例
A1型 体心立方 8 Zn
A2型 六方 12 Ag
A3型 面心立方 12 Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li
D.金刚石>SiO2>NaCl>钠
查看答案和解析>>
科目:高中化学 来源: 题型:
下面有关金属的叙述正确的是( )
A.金属受外力作用时常常发生变形而不易折断,是由于金属离子之间有较强的作用
B.通常情况下,金属中的自由电子会发生定向移动,而形成电流
C.金属是借助金属离子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com