
将a mol•L﹣1的Na2CO3溶液与b mol•L﹣1的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断不正确的是()
A. c(Na+)+c(H+)>c(CO32﹣)+c(HCO3﹣)+c(OH﹣)
B. c(Na+)>c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
C. 若c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),则一定a<b
D. 若a=b,则溶液中c(HCO3﹣)>c(CO32﹣)
考点: 离子浓度大小的比较;盐类水解的原理.
专题: 电离平衡与溶液的pH专题.
分析: A.任何电解质溶液中都存在电荷守恒;
B.根据物料守恒判断;
C.碳酸根离子水解程度大于碳酸氢根离子;
D.若a=b,物质的量浓度相同的碳酸钠和碳酸氢钠,碳酸钠的水解能力强.
解答: 解:A.溶液中存在电荷守恒c(Na+)+c(H+)=2c(CO32﹣)+c(HCO3﹣)+c(OH﹣),所以c(Na+)+c(H+)>c(CO32﹣)+c(HCO3﹣)+c(OH﹣),故A正确;
B.碳酸钠中存在物料守恒c(Na+)=2c(CO32﹣)+2c(HCO3﹣)+2c(H2CO3),碳酸氢钠中存在物料守恒c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3),混合溶液中存在物料守恒,根据碳酸钠中的物料守恒得c(Na+)>c(CO32﹣)+c(HCO3﹣)+c(H2CO3),故B正确;
C.碳酸根离子水解程度大于碳酸氢根离子,如果混合溶液中c(HCO3﹣)>c(CO32﹣),则可能存在a=b,故C错误;
D.若a=b,物质的量浓度相同的碳酸钠和碳酸氢钠,碳酸钠的水解能力强,碳酸钠水解生成碳酸氢钠与氢氧化钠,所以溶液中c(HCO3﹣)>c(CO32﹣),故D正确;
故选C.
点评: 本题考查了离子浓度大小比较,根据盐类水解特点、水解程度再结合电荷守恒、物料守恒来分析解答,易错选项是D,采用逆向思维方法解答,题目难度中等.


科目:高中化学 来源: 题型:
在下列化学方程式中,不能用离子方程式Ba2++SO42﹣=BaSO4↓表示的是()
A. BaCl2+H2SO4=BaSO4↓+2HCl
B. Ba(OH)2+Na2SO4=BaSO4↓+2NaOH
C. Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
D. Ba(OH)2+H2SO4=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有大量下列阴离子:OH﹣、SO42﹣、CO32﹣、Cl﹣.
(1)当溶液中存在大量H+时,则溶液中不可能有大量的 .
当溶液中有大量的Ba2+存在时,则溶液中不可能有大量的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4③NH4HCO3 ④NH4HSO4⑤NH4Cl ⑥NH3•H2O;按c(NH4+)由小到大的排列顺序正确的是()
A. ③⑤④⑥①③ B. ⑥⑤③④①② C. ⑥③⑤④①② D. ⑥③⑤④②①
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05mol•L﹣1的CuCl2溶液,B池中加入0.1mol•L﹣1的AgNO3溶液,进行电解.a、b、c、d四个电极上所析出的物质的物质的量之比是()
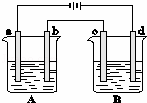
A. 1:1:2:1 B. 2:1:1:1 C. 2:2:4:1 D. 2:1:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:
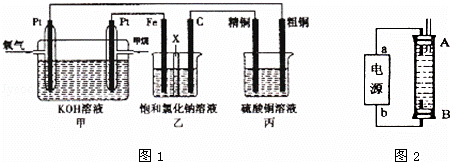
(1)甲烷燃料电池负极电极反应式是: ;
(2)石墨电极(C)的电极反应式为 ;
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体体积为 L;丙装置中阴极析出铜的质量为 g;
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图2所示).
若用于制漂白液时a为电池负极,电解质溶液最好用 .
若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用铁作电极.
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在溶液中可发生以下反应:①H++Z﹣+XO4﹣=X2++Z2+H2O(未配平),②2M2++R2=2M3++2R﹣,③2R﹣+Z2=R2+2Z﹣,由此判断下列说法正确的是()
A. 常温下反应2M2++Z2=2M3++2Z﹣不可以自发进行
B. R元素在反应②中被氧化,在③中被还原
C. 反应①配平后,H2O的化学计量数为8
D. 还原性强弱顺序为:X2+>Z﹣>R﹣>M2+
查看答案和解析>>
科目:高中化学 来源: 题型:
I.下列物质中属于强电解质的是 ;属于弱电解质的是 ;属于非电解质的是 .(填序号) ①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
II.某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O.已知K2S2O8的氧化性比K2Cr2O7强.
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)
(2)反应中,被还原的物质是 是
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
①标准状况下,22.4L己烯含有的分子数为NA
②标准状况下,22.4L氧气和氮气的混合物含有的分子数约为NA
③7.1g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2NA
④1mol氨气中含有的共价键数约为4NA
⑤500mL1mol/L的硫酸铝溶液中含有的硫酸根离子数约为1.5NA.
A. ①④ B. ②⑤ C. ③④ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com