
| A. | 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA | |
| B. | 分子数目为0.1NA的CH4和NH3混合气体,原子间含有的共用电子对数目为0.4NA | |
| C. | 25℃时,PH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1NA | |
| D. | 将1mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA |
分析 A.氯气溶于水,部分与水反应,部分以氯气分子形式存在;
B.1个氨气分子含有4对共用电子对,1个氨气分子含有3对共用电子对;
C.溶液体积未知;
D.依据电荷守恒判断.
解答 解:A.氯气溶于水,部分与水反应,部分以氯气分子形式存在,依据氯原子个数守恒,将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2NA,故A错误;
B.1个氨气分子和1个甲烷分子含有共用电子对数不同,无法计算0.1mol混合物含有电子对数,故B错误;
C.溶液体积未知,无法计算微粒个数,故C错误;
D.将1mol NH4NO3溶于稀氨水中使溶液呈中性,则溶液中存在电荷守恒:[H+]+[NH4+]=[NO3-]+[OH-],溶液呈中性,则铵根离子浓度等于硝酸根离子浓度,溶液体积相等,则氨根离子数目等于硝酸根离子数,为1mol,溶液中NH4+数目为NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加得罗常数的关系,注意溶液中电荷守恒的应用.


科目:高中化学 来源: 题型:选择题
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:A->B->C->D- | ||
| C. | 2A-+D2═2D-+A2反应不可以进行 | D. | 2C-+B2═2B-+C2反应能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=l的溶液:Ba2+、Al3+、Cl-、SO42- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、I- | |
| C. | c(OH-)/c(H+)=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 含有0.1mol/LFe(NO3)2的溶液:H+、Mg2+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和铜在自然界中主要以游离态的形式存在 | |
| B. | 工业上在高温下用CO还原含Fe2O3的铁矿石炼铁 | |
| C. | 常温下铁与浓硫酸不反应 | |
| D. | 用激光照射硫酸铜溶液可观察到丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 符合分子通式CnH2n+2的烃一定都是烷烃,分子中均只含单键 | |
| B. | 通过石油裂化可以得到多种气态短链烃,其中包括重要化工原料 | |
| C. | 苯能使溴水褪色,说明苯环结构中含有碳碳双键 | |
| D. | 乙醇可以被氧气氧化成乙酸,但乙酸无法再被氧气氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
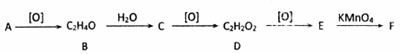
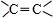 ,其产量可以用来衡量一个国家石油化工的发展水平.
,其产量可以用来衡量一个国家石油化工的发展水平.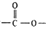 ,且无环状结构的同分异构体有8种.(不考虑立体异构)
,且无环状结构的同分异构体有8种.(不考虑立体异构)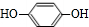 .
.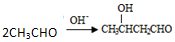 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeBr2溶液中加入少量氯水,再加 CCl4振荡 | CCl4层无色 | Fe2+的还原性强于Br- |
| B | 向盐酸中滴入少量NaAlO2溶液 | 无明显现象 | AlO2-与H+未发生反应 |
| C | 向某溶液里滴加NaOH溶液并将湿润的红色石蕊试纸罝于试管口 | 试纸颜色无 明显变化 | 原溶液中无NH4+ |
| D | 常温下,测定等物质的量浓度的 Na2CO3和Na2SO3溶液的pH | 前者的pH 比后者的大 | 元素非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 内容 | 评价 |
| A | 一定条件下0.5molN2和1.5molH2反应,平衡时放热akJ, 则N2(g)+3H2(g)?2NH3(g)+2aKJ | 正确 |
| B | 氯化镁溶液与氨水反应:Mg2++2OH-→Mg(OH)2↓ | 错误,氨水不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-→BaSO4↓ | 正确 |
| D | 等物质的量的Cl2与Na2SO3在溶液中反应:SO32-+Cl2→SO42-+2Cl- | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com