
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应,在t1时达到平衡:A(g)+ B(g)![]() xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
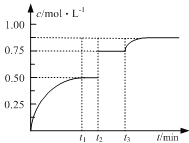
A.反应方程式中x=2
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量D
D.t1~t3间该反应的平衡常数相同
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称量8.2g含有少量中性易溶杂质的烧碱样品,配成500mL待测溶液。用0.1000molL1的硫酸溶液进行中和滴定测定该烧碱样品的纯度,试根据试验回答下列问题:
(1)滴定过程中,眼睛应注视____________,若用酚酞作指示剂达到滴定终点的标志是____________。
(2)根据表数据,计算烧碱样品的纯度是_______________(用百分数表示,保留小数点后两位)
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL)) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(3)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物合成中间体F制备路线如下:
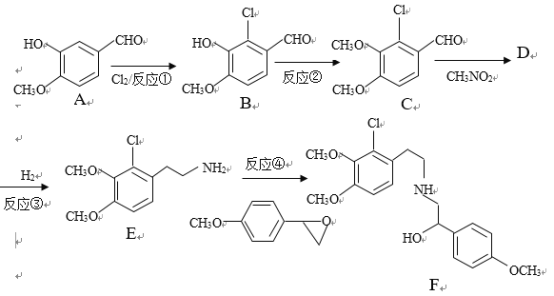
已知:RCHO+R’CH2NO2![]()
 +H2O
+H2O
(1)有机物A结构中含氧官能团的名称是__________________.
(2)反应②中除B外,还需要的反应物和反应条件是___________________
(3)有机物D的结构简式为_____________________,反应③中1摩尔D需要___摩尔H2才能转化为E
(4)反应④的反应物![]() 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
a.结构中含4种化学环境不同的氢原子
b.能发生银镜反应
c.能和氢氧化钠溶液反应
(5)已知:苯环上的羧基为间位定位基,如![]()
![]()
 。写出以
。写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)_____________。
的合成路线流程图(无机试剂任选)_____________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示,则下列说法正确的是( )
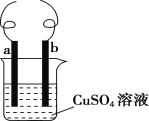
A.构成原电池时b极反应为Cu-2e-=Cu2+
B.构成电解池时a极质量一定减少
C.构成电解池时b极质量可能减少也可能增加
D.构成的原电池或电解池工作后均能产生大量气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型化学实验可以有效实现化学实验绿色化的要求。如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好。根据上述描述涉及到的元素,回答问题:
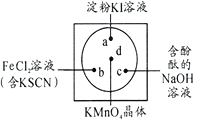
(1)KMnO4中Mn元素的化合价为:_______________,Fe在周期表中的位置是:_____________________。
(2)第三周期原子半径最小的原子共有______ 种不同能量的电子;长周期主族元素形成化合物的电子式为:__________________。
(3)结合已学知识分析a、c处的可能出现的现象:a:_____________________________;c:_________________________________;b处可能发生反应的离子方程式:___________________________________________________________
(4)已知溶液中,还原性为HSO3>I-,氧化性为IO3>I2>SO42.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示:
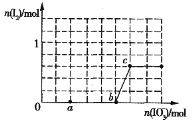
①a点处的还原产物是:____________(填离子符号); b点→c点反应的离子方程式是:_________________________________________
②当溶液中的I-为0.5mol时,加入的KIO3可能是:____________________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氯储罐中常混有NCl3,当液氯中NCl3的质量分数达到4%以上就有爆炸危险。
(1)NCl3易水解生成一种碱性气体和一种具有漂白性的物质。写出该反应的化学方程式________________________________________________。
(2)为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3(反应为:NCl3+4HCl→NH4Cl+3Cl2),再用400 mL 20.0%(ρ=1.22g/cm3)的工业NaOH溶液吸收所有的Cl2,测得吸收后NaOH溶液增重51.4 g。经测定NCl3吸收管内NH4+质量为0.270 g。
①上述工业NaOH溶液的物质的量浓度为____________。
②计算该样品中NCl3的质量分数,并判断该样品是否安全?(写出计算过程)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸的一种合成路线如下:
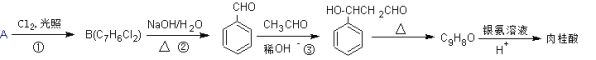
(1)烃A的名称为_________。反应①中B的产率偏低,其原因是________________________。
(2)反应②的化学方程式为_________________________________________________。
(3)反应③的反应类型是________________。
(4)肉桂酸的结构简式为__________________。
(5)反应③的产物同分异构体有多种,其中苯环上直接有一个甲基的酯类化合物有_____种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com