
| A、硫化钠是处理废水中含上述金属离子的沉淀剂 |
| B、在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜 |
| C、在含Hg2+、Cu2+、Pb2+的溶液中滴加硫化钠溶液,当c(S2-)=0.001 mol?L-1时三种金属离子都完全沉淀 |
| D、向含Pb2+、Cu2+、Hg2+的浓度均为0.010 mol?L-1的溶液中通人硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS |


科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、原子半径Z>W>Y |
| B、最高价氧化物对应水化物的酸性Z>W |
| C、氢化物的稳定性X>Z |
| D、X的氢化物与Y的氢化物能发生化合反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤ | B、①②③⑤ |
| C、④⑤ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
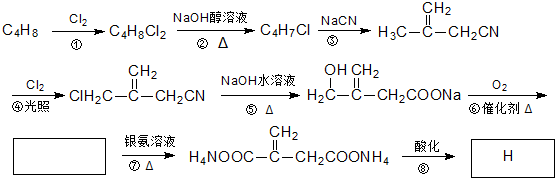
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、0~4分钟时,A的速率为0.01mol/(L?min) | ||
| B、由T1向T2变化时,V正>V | ||
C、该反应的平衡常数表达式K=
| ||
| D、此反应的正反应为吸热反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com