


科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| B | 将某混合气体通入品红溶液中 | 溶液不褪色 | 该混合气体中一定无SO2 |
| C | 向某溶液中滴加NaOH溶液,用红色石蕊试纸测溶液酸碱性 | 试纸变蓝 | 原溶液中有NH4+ |
| D | 向某溶液中先滴加KSCN溶液无明显现象,再加新制氯水 | 溶液呈血红色 | 原溶液中一定有Fe2+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
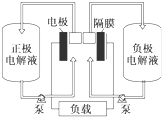 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图:回答下列问题:
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图:回答下列问题:+ 2 |
| 充电 |
| 放电 |
+ 2 |
+ 2 |
+ 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 第Ⅰ组 | 第Ⅱ组 | ||
| 被挑选出的单质 | ||||
| 挑选依据 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)═CH3OH(g)+H2O(g) | K3 | ||
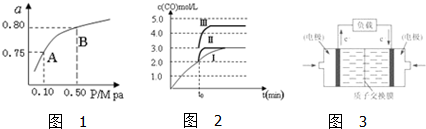
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、C2H4分子比例模型: |
| B、N2的结构式::N≡N: |
C、基态氮原子L层电子的轨道表示式: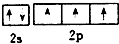 |
| D、基态溴原子的核外电子排布式:4s24p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若0.1mol?L-1的醋酸溶液pH=a,将其稀释10倍后,溶液的pH=b,则a<b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3mol/L盐酸的pH=3,1.0×10-8mol/L盐酸的pH=8 |
| D、若1mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com