
| A. | CH4与C4H10互为同系物 | |
| B. | C5H12有三种同分异构体 | |
| C. | 乙烯、乙醇和乙酸都可以使高锰酸钾溶液褪色 | |
| D. | 苯分子中的碳碳键是介于单键和双键之间的独特的键 |
分析 A.结构相似,在组成相差1个或若干个CH2原子团的化合物,互为同系物,注意同系物具有相同的官能团、官能团数目相同;
B.分子式相同,结构不同的化合物,互为同分异构体,根据烷烃同分异构体书写方法书写判断;
C.乙酸性质较稳定;
D.苯分子中的碳碳键是介于单键和双键之间的独特的化学键.
解答 解:A.CH4与C4H10都属于烷烃,分子式不同,相差3个CH2原子团,二者互为同系物,故A正确;
B.C5H12有正戊烷、异戊烷、新戊烷三种同分异构体,故B正确;
C.乙烯、乙醇能被氧化,乙酸性质较稳定,不能被高锰酸钾溶液褪色,故C错误;
D.苯分子中的碳碳键是介于单键和双键之间的独特的化学键,故D正确;
故选C.
点评 本题考查同系物、同分异构体、烷烃的性质、苯的结构,比较基础,注意基础知识的理解掌握.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用有少量蒸馏水的容量瓶配制溶液 | |
| B. | NaOH溶解后未冷却到室温即转移至容量瓶 | |
| C. | 移液后烧杯未用蒸馏水洗涤 | |
| D. | 定容时俯视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
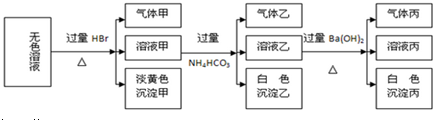
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Na+、OH-、Cl- | B. | Na+、K+、NO3-、Cl- | ||
| C. | Cu2+、Mg2+、CO32-、Cl- | D. | H+、Na+、MnO4-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | N2 | ||
| C. | NO2 | D. | 直径非常小的可吸入颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
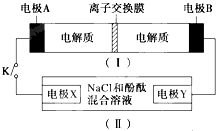 如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为;2K2S2+KI3$?_{充电}^{放电}$K2S4+3KI,装置(Ⅱ)为电解池的示意图当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为;2K2S2+KI3$?_{充电}^{放电}$K2S4+3KI,装置(Ⅱ)为电解池的示意图当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )| A. | 闭合K时,K十从左到右通过离子交换膜 | |
| B. | 闭合K时,A的电极反应式为:3I--2e-═I2- | |
| C. | 闭合K时,X的电极反应式为:2CI--2e-═Cl2↑个 | |
| D. | 闭合K时,当有0.1mo1K+通过离子交换膜,X电极上产生标准状况下气体2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl水溶液是强酸,任何强酸都导致有沉淀析出 | |
| B. | Cl-浓度增大,使平衡向生成氯化钠的方向移动,生成NaCl(s) | |
| C. | 酸的存在降低了Ksp(NaCl)的数值 | |
| D. | Ksp(NaCl)不受酸的影响,但增加Cl-浓度,能使Ksp(NaCl)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com