
 脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )
脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )| A. | 能发生加成反应 | B. | 属于芳香族化合物 | ||
| C. | 分子式为C13H16N2O2 | D. | 不能使酸性高锰酸钾溶液褪色 |
分析 由结构简式可知,分子中含碳碳双键、-CONH-及醚键等,结合烯烃、肽键的性质来解答.
解答 解:A.该分子中含有苯环和碳碳双键、羰基,具有苯、烯烃和酮的性质,所以能发生加成反应,故A正确;
B.该分子中含有苯环,所以属于芳香族化合物,故B正确;
C.脑白金的分子式为C13H16N2O2,故C正确;
D.脑白金的分子结构中含有碳碳双键,具有烯烃的性质,能发生加成反应,能使高锰酸钾酸性溶液褪色,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、肽键性质的考查,注重分析能力与知识综合应用能力的训练,注意分子中不含苯环,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题

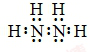 ;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-
;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将浓度均为0.10mol•L-1的CH3COONH4与CH3COONa溶液等体积混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) | |
| B. | 向0.10mol•L-1CH3COONa溶液中滴加盐酸至溶液呈中性:c(Cl-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 将0.10mol•L-1KHC2O4和0.10mol•L-1K2C2O4溶液等体积混合所得溶液中:2c(K+)=3c(C2O42-)+3c(HCO4) | |
| D. | 将等物质的量浓度的NH4HCO3与NaCl溶液等体积混合,析出部分NaHCO3晶体后的溶液(pH<7)中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
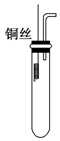 铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.
铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| B. | 用食醋检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 用氯化铁溶液腐蚀铜线路板:Cu+Fe3+═Fe2++Cu2+ | |
| D. | 用氢氧化钠溶液去除铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度相同、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H2 | ||
| C. | 体积相同、密度不相等的CO和C2H4 | D. | 压强相同、体积相同的O2和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g CH4O中含有的C-H键数目为NA | |
| B. | 25℃时,100mL pH=8的氨水中NH4+的个数为9.9×10-8NA | |
| C. | 56g Fe和64g Cu分别与1 mol S反应转移的电子数均为2NA | |
| D. | 标准状况下,2.24 LCl2溶于水所得氯水中含氯的微粒总数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com