
研究CO 、NO2、SO2等大气污染气体的处理具有重要意义。
(1)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)。在一定条件下将2 mol CO和6 mol H2充入2L的密闭容器中发生反应,5分钟后测得c(CO)=0.2 mol/L,计算此段时间的反应速率v(H2) =___________ mol/(L·min)。
CH3OH(g)。在一定条件下将2 mol CO和6 mol H2充入2L的密闭容器中发生反应,5分钟后测得c(CO)=0.2 mol/L,计算此段时间的反应速率v(H2) =___________ mol/(L·min)。
CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此条件的理由是
。

(2)已知:2SO2(g) + O2(g)![]() 2SO3(g) ΔH= —196.6 kJ·mol-1
2SO3(g) ΔH= —196.6 kJ·mol-1
2NO(g) + O2(g)![]() 2NO2(g) ΔH= —113.0 kJ·mol-1
2NO2(g) ΔH= —113.0 kJ·mol-1
则反应NO2(g) + SO2(g)![]() SO3(g) + NO(g) 的ΔH= kJ·mol-1。
SO3(g) + NO(g) 的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 (填序号)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol NO2的同时生成1 mol SO3
当测得上述反应平衡时NO2与SO2体积比为1:6,请列式计算反应NO2(g) + SO2(g)![]() SO3(g) + NO(g)的平衡常数K。
SO3(g) + NO(g)的平衡常数K。
科目:高中化学 来源: 题型:阅读理解
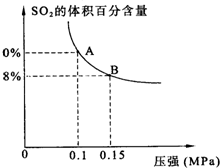 二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
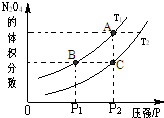 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:| c(H2)?c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com