
【题目】某含砷(As )的有毒工业废水经如下图流程转化为粗Aa2O3。已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
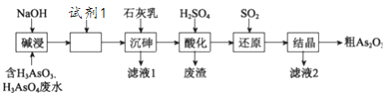
(1)加入试剂1的目的是:_________________________。
(2)“沉砷”是将砷元素转化为Ca5(AsO4)3OH 沉淀,发生的主要反应有:
A.Ca(OH)2(s) ![]() Ca2+(aq) + 2OH-(aq) ΔH <0
Ca2+(aq) + 2OH-(aq) ΔH <0
B.5Ca2+ + OH-+ 3AsO43-![]() Ca5(AsO4)3OH ΔH >0
Ca5(AsO4)3OH ΔH >0
研究表明:“沉砷”的最佳温度是85℃, 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是________。
(3)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________。
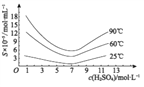
(4)通过对H3AsO3溶液进行_____(填操作名称),再过滤可制得粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如下图所示。为控制滤液2 中As2O3的浓度不高于6×10-5 mol·L-1 ,则“结晶”过程应控制的条件是______________________(例举一例回答)
(5)从绿色化学和综合利用的角度考虑,对滤液2 处理方法是:________________________。
【答案】 将AsO33-氧化为AsO43- A反应△H<0,升温促使A平衡向左移动,c(Ca2+)和c(OH-)减小,从而导致B平衡向左移动 H3AsO4+H2O+SO2=H3AsO3+H2SO4 加热 控制温度在60℃并将硫酸浓度调至7 molL﹣1。或:控制温度在25℃并将硫酸浓度调至7 molL﹣1。或:控制温度在60℃以下并将硫酸浓度调至7 molL﹣1。或:温度控制在25℃并将硫酸浓度调至3~11 molL﹣1。或:温度控制在25℃以下并将硫酸浓度调至3~11 molL﹣1 将滤液2输入“酸化”环节,循环使用
【解析】向工业废水(含有H3AsO4、H3AsO3)加入氢氧化钠碱浸:H3AsO4+3NaOH═Na3AsO4+3H2O、H3AsO3+3NaOH═Na3AsO3+3H2O,得到含有Na3AsO4、Na3AsO3的溶液,根据题意,亚砷酸钙微溶于水,砷酸钙难溶于水,需要加入氧化剂将Na3AsO3氧化为Na3AsO4,再加入石灰乳沉砷得到Ca5(AsO4)3OH沉淀,用稀硫酸溶解沉淀,生成H3AsO4和硫酸钙,通入二氧化硫将H3AsO4还原为H3AsO3,反应为:H3AsO4+H2O+SO2═H3AsO3+H2SO4,“还原”后加热溶液,H3AsO3分解为As2O3,调硫酸浓度约为7molL-1,冷却至25℃,过滤,得粗As2O3。
(1)根据上述分析,加入试剂1的目的是将AsO33-氧化为AsO43-,故答案为:将AsO33-氧化为AsO43-;
(2) “沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:A.Ca(OH)2(s)Ca2+(aq)+2OH-(aq)△H<0,B.5Ca2++OH-+3AsO43-Ca5(AsO4)3OH△H>0,温度升高高于85℃后,反应A平衡逆向移动,c(Ca2+)下降,反应B平衡逆向移动,Ca5(AsO4)3OH沉淀率下降,故答案为:A反应△H<0,升温促使A平衡向左移动,c(Ca2+)和c(OH-)减小,从而导致B平衡向左移动;
(3)“还原”过程中二氧化硫将H3AsO4还原为H3AsO3,自身被氧化生成硫酸,反应为:H3AsO4+H2O+SO2═H3AsO3+H2SO4;故答案为:H3AsO4+H2O+SO2═H3AsO3+H2SO4;
(4)对H3AsO3溶液加热,使H3AsO3分解为As2O3,再过滤可制得粗As2O3。由图可知:硫酸浓度约为7molL-1,25℃时As2O3的沉淀率最大,易于分离,故为了提高粗As2O3的沉淀率,调硫酸浓度约为7molL-1,冷却至25℃,过滤;故答案为:加热;调硫酸浓度约为7molL-1,冷却至25℃,过滤;
(5) 滤液2主要含有硫酸,可循环使用,故答案为:将滤液2输入“酸化”环节,循环使用。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
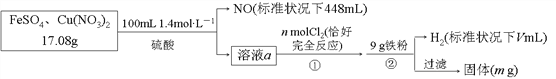
下列叙述中不正确的是( )
A. n=0.02 B. m=3.2
C. V=2240 D. 原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙烯、苯均能与H2发生加成反应,说明两者均含碳碳双键
B.相同质量的烃完全燃烧,耗氧量最大的是CH4
C.相同质量的乙炔、苯分别在足量氧气中燃烧,苯比乙炔消耗的氧气质量多
D.乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素位于第三周期第ⅣA族.下列叙述不正确的是( )
A.该元素是金属元素
B.该元素原子的核电荷数为14
C.该元素原子核外有3个电子层
D.该元素原子不容易得到或者失去最外层电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为空气的成分。F的焰色反应是黄色。在G中,金属元素与非金属元素的原子个数比为2:1。在一定条件下,各物质之间的相互转化关系如图(反应条件及部分产物未列出):
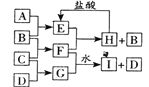
(1)A的元素符号是______________,F的电子式为________________________。
(2)E与F反应的化学方程式:_________________________________________。
(3)F与G的水溶液反应的离子方程式:______________________________。
(4)硫与热浓氢氧化钠溶液反应的离子方程式:__________________________。
(5)在加热条件下浓硝酸可把硫单质氧化到最高价产物,写出反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下四个实验探究氯水的成分,请根据下表回答问题。
实验序号 | 实验方法 | 实验现象 | 结论 |
① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
③ | 淀粉KI试纸变蓝色 | 氯水中含有Cl2 | |
④ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中含有H+ |
(1)实验①得出的结论__________________________________________。
(2)指出实验②和实验④中的“实验现象”:②_____________;④____________。
(3)实验③中“实验方法”的具体操作过程是:___________________________________。
(4)通过实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是a_____________,b._________。请设计简单的实验证明哪一个是正确的_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法正确的是
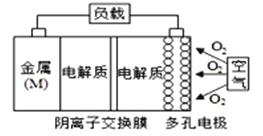
A. 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
B. M-空气电也放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
C. Al作电极材料时电解质溶液最好选酸性,这样更有利于反应的发生,同时防止负极区沉淀
D. 在Mg-空气电也中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
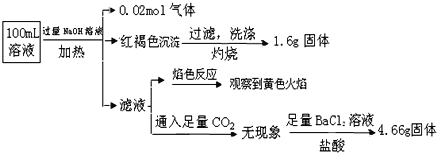
下列说法正确的是
A. 原溶液中c(Fe3+)=0.2mol/L
B. 溶液中至少有4种离子存在,其中Cl-一定存在
C. SO42-、NH4+、Na+一定存在,CO32-一定不存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com