
| A. | c(K+)+c(H+)═c(OH-)+c(HS-)+2 c(S2-) | B. | c(K+)>c(HS-)>c(OH-)>c(H+) | ||
| C. | c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1 | D. | c(K+)>c(HS-)>c(H+)>c(OH-) |
分析 KHS溶液显示碱性,说明HS-水解程度大于HS-电离程度,存在HS-?H++S2-,HS-+H2O?H2S+OH-,H2O?H++OH-,结合电荷守恒和物料守恒可解答该题.
解答 解:A.KHS溶液中遵循电中性原则,根据电荷守恒可得:c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-),故A正确;
B.溶液中存在水的电离,并且HS-水解程度大于HS-电离程度,则c(OH-)>c(H+),因水解程度较弱,则c(K+)>c(HS-)>c(OH-)>c(H+),又由于溶液中存在水的电离,则c(H+)>c(S2-),则溶液中正确的电离平衡为:c(K+)>c(HS-)>c(OH-)>c(H+)>c(S2-),故B正确;
C.0.1mol•L-1KHS溶液中含有:HS-、S2-、H2S,由物料守恒可知c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1,故C正确;
D.溶液中存在水的电离,并且HS-水解程度大于HS-电离程度,则c(OH-)>c(H+),因水解程度较弱,则c(K+)>c(HS-)>c(OH-)>c(H+),又由于溶液中存在水的电离,则c(H+)>c(S2-),则溶液中正确的电离平衡为:c(K+)>c(HS-)>c(OH-)>c(H+)>c(S2-),故D错误;
故选D.
点评 本题考查离子浓度大小比较、盐的水解原理的应用,题目难度中等,本题注意KHS溶液呈碱性、HS-水解程度大于HS-电离程度,注意电荷守恒和物料守恒的利用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入适量铁粉 | |
| B. | 等物质的量浓度、等体积的Ca(HCO3)2与NaOH溶液 | |
| C. | 等物质的量的NaHCO3与Na2O2固体 | |
| D. | 在NaBr、NaI的混合液中通入过量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(酸)=10V(碱) | B. | V(碱)=10V(酸) | C. | V(酸)=9V(碱) | D. | V(碱)=9V(酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ Mg2+ |
| 可能大量含有的阴离子 | Cl-Br-I?AlO2- CO32- |
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+)/c(NH3•H2O)先增大再减小 | |
| C. | 当加入氨水的体积为10 mL时,溶液中的离子浓度:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10 mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用规格为10 mL的量筒量取6mL的液体 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
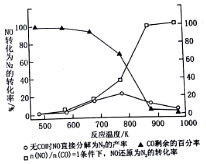 雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.
雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com