
| A. | 打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫 | |
| B. | 镀层破损后,马口铁(镀锡的铁)比白铁(镀锌的铁)更易腐蚀 | |
| C. | 加热后的纯碱水洗油污比冷碱水效果好 | |
| D. | FeCl3滴入沸水中,煮沸片刻得到红褐色胶体 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关、与平衡移动无关,则不能用勒夏特利原理解释.
解答 解:A.因溶液中存在二氧化碳的溶解平衡,开启啤酒瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故A不选;
B.镀层破损后容易形成原电池放腐蚀,马口铁(镀锡的铁)中Fe比Sn活泼,Fe为负极,容易发生,而比白铁(镀锌的铁)中Zn比Fe活泼,Zn被发生,Fe被保护,故马口铁更易腐蚀,与平衡移动无关,不能能用勒夏特利原理解释,故B选;
C.碳酸根水解CO32-+H2O?HCO3-+OH-,溶液呈碱性,水解过程是吸热过程,升高温度促进碳酸根水解,碱性增强,去油污能力增强,能用勒夏特利原理解释,故C不选;
D.FeCl3滴入沸水中,存在水解平衡FeCl3+3H2O?Fe(OH)3(胶体)+3HCl,煮沸促进水解进行,得到红褐色胶,能用勒夏特利原理解释,故D不选;
故选B.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.


科目:高中化学 来源: 题型:解答题
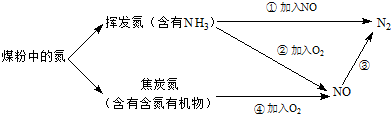
 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀HNO3和Fe(NO3)2 | B. | 铁和ZnSO4 | C. | Zn和FeCl2 | D. | Fe和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,等物质的量的乙烯(C2H4)和CO所含的分子数目相等 | |
| B. | 等物质的量的N2和CO在标准状况下的体积均为22.4L | |
| C. | 同温同压下,等体积的物质所含分子数目一定相等 | |
| D. | 1molHCl中所含的分子数目和1L1mol/L盐酸中所含的分子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
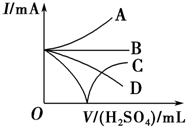 向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑤ | C. | ①②③④⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com