
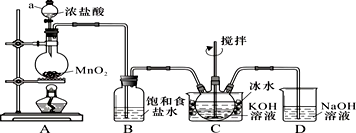
| 实验方案 | 实验目的 | |
| A |  | 验证FeCl3对H2O2分解反应有催化作用 |
| B | 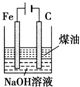 | 制备Fe(OH)2并能较长时间观察其颜色 |
| C | 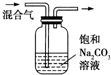 | 除去CO2气体中混有的SO2 |
| D |  | 比较Cl、C和Si的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.要验证验证FeCl3对H2O2分解反应有催化作用,应该只有催化剂不同,其它条件必须完全相同;
B.亚铁离子和OH-反应生成Fe(OH)2,Fe(OH)2易被氧气氧化,所以要防止生成的Fe(OH)2被氧化;
C.二氧化碳、二氧化硫都能和碳酸钠溶液反应;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸.
解答 解:A.要验证验证FeCl3对H2O2分解反应有催化作用,应该只有催化剂不同,其它条件必须完全相同,该实验中催化剂、温度都不同,所以不能验证FeCl3对H2O2分解反应有催化作用,故A错误;
B.亚铁离子和OH-反应生成Fe(OH)2,Fe(OH)2易被氧气氧化,所以要防止生成的Fe(OH)2被氧化,Fe作阳极时生成亚铁离子进入溶液,亚铁离子和OH-反应生成Fe(OH)2,煤油能隔绝空气,防止氢氧化亚铁被氧化,故B正确;
C.二氧化碳、二氧化硫都能和碳酸钠溶液反应,应该用饱和的碳酸氢钠除去二氧化碳中的二氧化硫,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,HCl不是Cl元素的最高价氧化物的水化物,且生成的二氧化碳中含有挥发的HCl,HCl也和硅酸钠溶液而干扰二氧化碳的反应,所以该实验不能比较非金属性强弱,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、化学反应速率影响因素、除杂、非金属性强弱判断等知识点,明确实验原理、物质性质、实验基本操作是解本题关键,侧重考查学生实验操作、实验评价能力,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 月桂烯(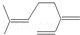 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲苯能使溴水和KMnO4溶液褪色 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | DCHP的分子式为C20H26O4 | |
| B. | 环己醇分子中所有碳原子不可能共平面 | |
| C. | DCHP的一氯取代物有5种 | |
| D. | DCHP通过取代反应可以得到环已醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用蛋白质可以为人体提供氨基酸 | |
| B. | 加碘盐中的碘是I2 | |
| C. | 袋装食品里放置的小袋硅胶是抗氧化剂 | |
| D. | 发酵粉中的小苏打是Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com