
【题目】在标准状况下CH4、HCl、H2S、NH3均为气体。在标准状况下分别有①13.44 LCH4 ②1mol HCl分子 ③27.2 g H2S ④ 2.408×1023个NH3分子,下列说法正确的是( )
A.密度:②>③>①>④B.质量:②>③>④>①
C.H原子个数:①>③>④>②D.体积:②>③>④>①
【答案】C
【解析】
①13.44LCH4物质的量为![]() =0.6mol,②1molHCl,③27.2gH2S的物质的量为
=0.6mol,②1molHCl,③27.2gH2S的物质的量为![]() =0.8mol,④2.408×1023个NH3分子的物质的量为
=0.8mol,④2.408×1023个NH3分子的物质的量为![]() =0.4mol,
=0.4mol,
A. 相同条件下,气体的体积之比等于物质的量之比,所以体积体积②>③>①>④,故A错误;
B. 各物质的摩尔质量分别为:①CH4为16g/mol,②HCl为36.5g/mol,③H2S为34g/mol,④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,故B错误;
C. 各物质的质量分别为:①CH4为0.6mol×16g/mol=9.6g,②HCl为1mol×36.5g/mol=36.5g,③H2S为27.2g,④NH3为0.4mol×17g/mol=6.8g,所以质量②>③>①>④,故C错误;
D. 各物质中H原子的物质的量分别为:①CH4中氢原子物质的量为0.6mol×4=2.4mol,②HCl中氢原子物质的量为1mol,③H2S中氢原子物质的量0.8mol×2=1.6mol,④NH3中氢原子物质的量为0.4mol×3=1.2mol,所以氢原子个数①>③>④>②,故D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】按要求完成下列各题
(1)写出硫酸氢钠在水溶液中的电离方程式___;
(2)写出下列反应的离子方程式:
①氧化镁加入稀硫酸中___;
②氨水中加入稀盐酸___;
③FeCl3溶液中加入NaOH溶液:___。
(3)在标准状况下,4.48L的NH3气体物质的量为___mol,质量为___g,其中含___个氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(CN)2、(SCN)2、(OCN)2称“类卤素”,与卤素单质的性质相似,而其阴离子性质也相似,如:2Fe + 3(SCN)2="==" 2Fe(SCN)3,2Fe + 3Cl2="==" 2FeCl3。以此判断下列化学方程式中错误的是
A.(CN)2+ H2O![]() HCN + HCNO
HCN + HCNO
B.(SCN)2+ 2Cu![]() 2CuSCN
2CuSCN
C.(OCN)2+ 2NaOH ="==" NaOCN + NaOCNO + H2O
D.MnO2+ 4HSCN(浓)![]() (SCN)2 + Mn(SCN)2+ 2H2O
(SCN)2 + Mn(SCN)2+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A.阿伏加德罗常数就是指6.02×1023
B.3.01×1023个Na+中电子的物质的量是5 mol
C.1 mol任何物质所含有的原子数都相同
D.2 mol SO42-约含有1.204×1023个SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题
(1)利用甲烷催化可还原NOx,相关反应如下
N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1160kJ·mol-1
写出常温常压下,甲烷完全燃烧的热化学方程式:_______。
(2)在催化剂条件下,可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)。分别在T1、T2两个温度下,向容积均为2L的甲、乙两个恒容密闭容器中分別充入0.20 mol NO(g)和0.20 mol CO(g)。反应过程中两容器中CO2的物质的量浓度随时间的变化关系如图所示。

①甲容器中,用NO表示5min内反应速率为_____。
②T1___(填“>”或“<”)T2,该反应是_____(填“吸热”或“放热”)反应。
③T2温度时,该反应的平衡常数是_____L/mol(结果保留小数点后两位),与T2时相比,T1温度时的平衡常数更___(填“大”或“小”)。
④乙容器达到平衡后,再充入0.10mlNO和0.10molCO2,此时υ(正)___(填“>”或“<”)v(逆)。
(3)NO2和NO的混合物可被NaOH吸收生成 NaNO2。已知HNO2是一元弱酸,写出NaNO2溶液中离子浓度的大小关系:___。常温下,pH=9的NaNO2溶液中,c(Na+)—c(NO2-)=_______(列出数学计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组欲配制245mL 0.1mol/L硫酸亚铁溶液,实验室有如下两种试剂:①FeSO4·7H2O,②5mol/LFeSO4溶液,现分两小组分别进行实验,第一小组选择试剂①,第二小组选择试剂②。
(1)第一小组称量试剂①的质量为__________g。
(2)第二小组经计算需要______mL5mol/LFeSO4溶液,在量取试剂②后,进行了下列操作:
a.等稀释的溶液的温度与室温一致后,沿玻璃棒注入容量瓶中。
b. ________使溶液的液面与瓶颈的刻度标线相切。
c.在盛FeSO4溶液的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
d.用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。若量取的是浓硫酸,简述第c步实验的具体操作步骤:________
(3)在上述配制过程中,若出现以下情况,对溶液浓度有何影响?
A 用量筒量取试剂②时仰视观察凹液面。
B 稀释的FeSO4溶液未恢复至室温,沿玻璃棒注入容量瓶中。
C 未用蒸馏水洗涤烧杯和玻璃棒。
D 定容时,仰视观察凹液面。
E 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。
F 配制溶液时,容量瓶中有蒸馏水。
偏高:______________ 偏低:____________ 无影响:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
A. 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C. 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D. 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了测定某品牌铝合金中铝的含量,现设计了如下实验:
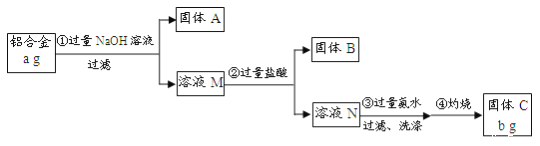
已知:该铝合金的主要成分为Al2O3、MgO、CuO、SiO2;2NaOH+SiO2=Na2SiO3+H2O;Na2SiO3+
2HCl=2NaCl+H2SiO3↓。
请回答下列问题:
(1)固体A的成分是_______;
(2)步骤③中生成沉淀的离子方程式为_____;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为______;
(4)该样品中铝的质量分数是______。(用a、b表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3COCH3(1) ![]() CH3COCH2COH(CH3)2(1)。取等量CH3COCH3分别在0℃和20℃下反应,测得其转化率(α)随时间(t)变化的关系曲线如下图所示。下列说法正确的是( )
CH3COCH2COH(CH3)2(1)。取等量CH3COCH3分别在0℃和20℃下反应,测得其转化率(α)随时间(t)变化的关系曲线如下图所示。下列说法正确的是( )
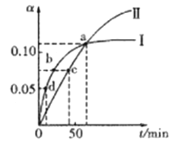
A. 化学反应速率的大小顺序为:d>b>c
B. 升高温度能提高反应物的平衡转化率
C. 在a点时,曲线Ⅰ和Ⅱ表示反应的化学平衡常数相等
D. 曲线Ⅱ表示20℃时的转化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com