
分析 (1)49g硫酸的物质的量为:$\frac{49g}{98g/mol}$=0.5mol,所含氧原子的物质的量为:0.5mol×4=2mol,氢原子的物质的量为:0.5mol×2=1mol,由此分析解答;
(2)m=nM,结合分子的构成解答;
(3)中子数等于=质量数-质子数;阴离子电子数=质子数+电荷数;
(4)根据氯离子物质的量计算ACl2的物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,进而计算A的相对原子质量;
(5)根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液质量,再根据V=$\frac{m}{ρ}$计算溶液体积,根据c=$\frac{n}{V}$计算溶液物质的量浓度,根据$\frac{溶质质量}{溶液质量}$×100%计算溶液质量分数.
解答 解:(1)49g硫酸的物质的量为:$\frac{49g}{98g/mol}$=0.5mol,所含氧原子的物质的量为:0.5mol×4=2mol,氢离子的物质的量为:0.5mol×2=1mol,所以氢离子的数目为:6.02×1023;故答案为:0.5;2;6.02×1023;
(2)由m=nM可知,氧气与臭氧的质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1,分子数之比等于物质的量之比为0.6mol:0.4mol=3:2,故答案为:1:1;3:2;
(3)中子数等于=质量数-质子数=34-16=18;阴离子电子数=质子数+电荷数=16+2=18,故答案为:18; 18;
(4)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的物质的量为$\frac{0.4mol}{2}$=0.2mol,ACl2的摩尔质量是$\frac{19g}{0.2mol}$=95 g•mol-1,则A的相对原子质量为95-35.5×2=24,故答案为:95g/mol;24;
(5)300L HCl的物质的量为$\frac{300L}{22.4L/mol}$=$\frac{300}{22.4}$mol,则HCl的质量为$\frac{300}{22.4}$mol×36.5g/mol,1L水的质量为1000g,故溶液质量为1000g+$\frac{300}{22.4}$mol×36.5g/mol,
则溶液体积为:$\frac{1000g+\frac{300}{22.4}mol××36.5g/mol}{1159g/L}$=,
故溶液物质的量浓度为:$\frac{\frac{300}{22.4}}{\frac{1000g+\frac{300}{22.4}×36.5}{1159}}$=10.4mol/L,
溶液质量分数为$\frac{\frac{300}{22.4}×36.5}{1000+\frac{300}{22.4}×36.5}$×100%=32.8%,
故答案为:32.8%; 10.4mol/L.
点评 本题考查溶液浓度计算,涉及物质的量浓度、质量分数计算,注意对公式的理解,题目计算量较大,为易错题目.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{4M}{{a}^{3}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物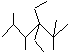 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 酯类物质是形成水果香味的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4 mol | B. | 4 mol | C. | 2.8 mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | Na2CO3溶液中:c(OH-)+2 c(CO32-)+c(HCO3-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL碱式滴定管准确量取22.00 mL的KMnO4溶液 | |
| B. | 用托盘天平准确称取9.8g NaCl 固体 | |
| C. | 用广泛pH试纸测出某盐酸溶液的pH为3.2 | |
| D. | 用10mL量筒量取7.50mL稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酒精灯打翻在实验台上失火时,立即用湿抹布盖灭 | |
| B. | 不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积水,而后边搅拌边慢慢加入浓硫酸 | |
| D. | 做实验时不准直接用手接触药品、不准尝试药品、不准直接闻气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡的电离方程式为Ba(OH)2=Ba2++2OH- | |
| B. | 强弱电解质的本质区别是溶液的导电性强弱 | |
| C. | 电解质与非电解质的本质区别是水溶液能否导电 | |
| D. | 硫酸氢钠是强电解质,碳酸氢钠是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中慢慢滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 | |
| B. | 胶体与其他分散系的本质区别是胶体能发生丁达尔效应 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 纯碱和烧碱都属于碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com