
有四种物质的量浓度相等且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液。据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐是( )
A.BX B.AX
C.AY D.BY
科目:高中化学 来源: 题型:
25 ℃时,将体积为Va、pH=a的某一元酸与体积为Vb、pH=b的某一元碱混合,请完成下列各题。
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7。由此你能得到的结论是________________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00 mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11 mL。则b=________。
(3)若已知Va<Vb,a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组原子中,化学性质一定相似的是 ( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子
D.最外层都只有一个电子的X、Y原子
查看答案和解析>>
科目:高中化学 来源: 题型:
有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N),其中,只含有极性键的是________;只含有非极性键的是________;既有极性键,又有非极性键的是______________;只有σ键的是______________;既有σ键又有π键的是__________;含有由两个原子的s轨道重叠形成的σ键的是____________;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是____________;含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CH3COOH??CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka= ;CH3COO-+H2O??CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
;CH3COO-+H2O??CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh= (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是______________________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=________(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;
②________________________________________________________________________;
③用____________(填一种实验方法)测定溶液浓度c′。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
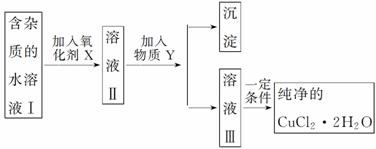
请回答下列问题:
(1)本实验最适合的氧化剂X是________(填字母)。
A.K2Cr2O7 B.NaClO
C.H2O2 D.KMnO4
(2)物质Y是________。
(3)本实验用加碱沉淀法能不能达到目的?__________,原因是________________________________________________________________________。
(4)除去Fe3+的有关离子方程式是___________________________________________。
(5)加氧化剂的目的是_______________________________________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________,应如何操作?________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答下列问题。
(1)NH4Cl溶液显________性,用离子方程式表示原因
________________________________________________________________________,
其溶液中离子浓度大小顺序为____________________________________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=________,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_____________________________________。
(3)已知纯水中存在如下平衡:H2O+H2O??H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com