
| A. | 石灰石可用于炼铁、制水泥、制玻璃 | |
| B. | 使用苯代替酒精擦拭手机屏幕 | |
| C. | 同位素示踪法、红外光谱法都是科学家经常使用的研究化学反应历程的手段之一 | |
| D. | 针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学的核心 |
分析 A.根据炼铁、制水泥、制玻璃的主要原料分析;
B.苯有毒,不能用于擦拭手机屏幕;
C.根据化学反应历程的确定方法来回答判断;
D.根据绿色化学的核心,要注意从源头消除污染.
解答 解:A.生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;石灰石还是炼铁的一种原料(造渣材料),所以在炼铁、制玻璃、制水泥三种工业生产中都用到石灰石,故A正确;
B.用于苯有毒,所以不能使用苯代替酒精擦拭手机屏幕,故B错误;
C.红外光谱法不能用于研究反应历程,故C错误;
D.选用含氯消毒剂的处理方法不符合绿色化学的核心,故D错误;
故选A.
点评 本题考查了物质组成、结构、性质及其应用,题目难度不大,明确常见元素及其化合物性质为解答关键,试题知识点较多,充分考查了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 6种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:| 序号 | A | B | 烧杯中的液体 | 灵敏电流计指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Cu | 乙醇 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 L 0.1 mol•L-1 的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L己烷中共价键数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中含有的碳原子数为2NA | |
| D. | 足量Fe与标准状况下22.4 L Cl2充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
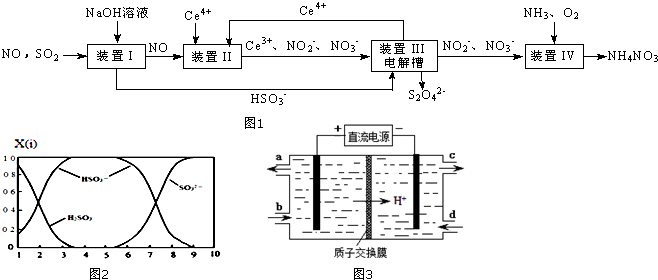
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
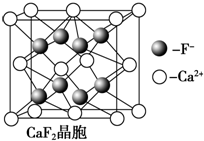
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 浓度(mol•L-1) | 0 | 5 | 10 | 15 | 25 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | a | a | b | b |
| CO2 | 0 | 0.21 | a | a | 0.36 | 0.36 |
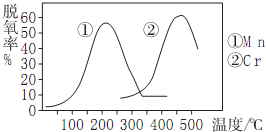
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸与氢氧化钠溶液反应:H++OH-=H2O | |
| B. | 铝与稀盐酸反应:Al+2H+=Al3++H2↑ | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3C1- | |
| D. | 二氧化碳与澄清石灰水反应:CO2+2OH-=CO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com