
已知:2CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol 某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol 某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
A. 平衡时,c(CH3OCH3)=1.6 mol/L B.平衡后升高温度,平衡常数>400
C. 平衡时,反应混合物的总能量减少20 kJ
D. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
科目:高中化学 来源: 题型:
下列关于有机物的叙述正确的是 ( )
A.甲苯分子中所有原子均在同一个平面上
B.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
C.在酸性条件下,CH3C18OOC2H5的水解产物是CH3C18OOH和C2H5OH
D.淀粉、天然油脂、蛋白质都属于天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
手性分子是指在分子结构 中,当a、b、c、d为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用★标记)属于手性碳原子的是
中,当a、b、c、d为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用★标记)属于手性碳原子的是
A.降冰片烯 B.乳酸
B.乳酸
C.苯甲醇  D.甘油
D.甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42 - =BaSO4↓+2H2O
B.Cl2通入NaOH溶液:Cl2+2OH一=Cl―+ClO―+H2O
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO― 2+4NH+4+2H2O
D.铅酸蓄电池充电时的正极反应:PbSO4+ 2H2O-2e- = PbO2+4H++SO42 -
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是四位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
A. 使用冰箱保存食物,是利用了化学反应速率理论
B. 化学平衡理论是研究怎样使用有限原料多出产品
C. 使用催化剂,可加快反应速率,目的是提高生产效率
D. 化学反应速率理论是研究怎样提高原料转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出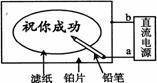 现红色字迹。据此下列叙述正确的是( )
现红色字迹。据此下列叙述正确的是( )
A.铅笔芯作阳极,发生氧化反应
B.a为电源的正极
C.铅笔尖附近有少量的氯气产生
D.红字是H+放电, c(OH-)增大造成
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列
问题:
(1)氮元素原子的L层电子数为________;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式_______________________________。
(4)已知H2O(l)===H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为________________________________________________________。
(5)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质是由3种氨基酸分子脱水缩合生成的四肽的结构简式:

这种四肽彻底水解时,不可能产生的氨基酸是( )
A.  B.
B.
C. NH2—CH2—COOH D.
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: 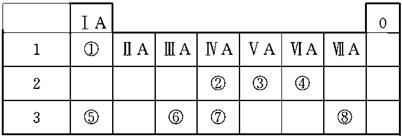
(1)④、⑤、⑥的原子半径由大到小的顺序是____________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_____________________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_______________________________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com