
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.足量MnO2和100mL6mol/L浓盐酸反应产生Cl2的分子数为0.15NA
B.100mL1molFeCl3溶液中所含Fe3+的数目为0.1NA
C.48g正丁烷和10g异丁烷的混合物中碳碳单键的数目为3NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
【答案】C
【解析】
A.100mL 6molL-1浓盐酸中含有氯化氢0.1L×6molL-1=0.6mol,MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,完全反应0.6mol氯化氢可以生成0.15mol氯气,由于稀盐酸不与二氧化锰反应,所以生成的氯气的物质的量小于0.15mol,产生的氯气分子数小于0.15NA,故A错误;
MnCl2+Cl2↑+2H2O,完全反应0.6mol氯化氢可以生成0.15mol氯气,由于稀盐酸不与二氧化锰反应,所以生成的氯气的物质的量小于0.15mol,产生的氯气分子数小于0.15NA,故A错误;
B.Fe3+为弱碱阳离子,水溶液中部分水解,故100 mL 1 molL-1FeCl3溶液中所含Fe3+数目小于0.1NA,故B错误;
C.正丁烷和异丁烷只是碳架不同,含有的碳碳单键均为3条,所以48g正丁烷和10g异丁烷,即混合物的物质的量为![]() =1mol,所以48g正丁烷和10g异丁烷的混合物中碳碳单键数目为3NA,故C正确;
=1mol,所以48g正丁烷和10g异丁烷的混合物中碳碳单键数目为3NA,故C正确;
D.SO2和O2的催化反应为可逆反应,反应不可能完全进行,所以密闭容器中,反应生成三氧化硫的物质的量小于2mol,则反应后气体总物质的量大于2mol,反应后分子总数大于2NA,故D错误;
故选C。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
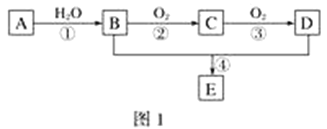
(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。
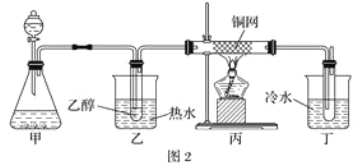
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
序号 | 装置 | X溶液 | 现象 |
I |
| 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
II | Na2SO4 | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
III | H2SO4 | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |
A. 实验I中溶液红色褪去,说明发生了反应H+ + OH- =H2O
B. 实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH-
C. 实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O
D. 将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中,正确的是:
A. 常温下,pH=11的Na2CO3溶液中,水电离出的c(OH-)=1.0×10-3molL-1
B. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液的大
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 加热蒸干AlCl3溶液可得到AlCl3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I是一种医药合成中间体,实验室以芳香烃A为原料制备I的路线如下(部分反应条件已省略):
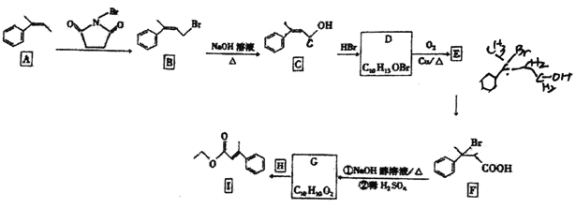
已知:RCH=CH2+HBr![]() RCH2CH2Br。回答下列问题:
RCH2CH2Br。回答下列问题:
(1)X的分子式为C8H8,且X与A互为同系物,则X的化学名称是 ______。
(2)B生成C的反应类型是_____, B、C含有的相同的官能团名称是 _____。
(3)碳原子上连有4个不同原子或基团时,该碳原子为手性碳原子。写出D的结构简式,并用星号![]() 标出其中的手性碳原子_____。
标出其中的手性碳原子_____。
(4)写出D—E 的化学反应方程式:_________。
(5)G的结构简式是 ______。
(6)Y与C是同分异构体,Y中含苯环,且苯环上有2个取代基,Y能发生银镜反应,其核磁共振氢谱中有5组峰,且峰面积之比为6:2:2:1:1,则Y的结构简式为 _______。
(7)丙二酸(HOOCCH2COOH)主要用作医药合成中间体、电镀抛光剂等。结合题目信息,设计以丙烯(CH3CH=CH2) 和![]() 为原料制备丙二酸的合成路线______(无机试剂任选)。
为原料制备丙二酸的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺[2,2]戊烷的结构简式如图。下列关于该化合物的说法错误的是( )

A.与环戊烯互为同分异构体B.二氯代物超过两种
C.所有碳原子不共平面D.与丙烷互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
现有下列七种物质:①液态氯化氢;②小苏打;③纯碱粉末;④葡萄糖;⑤氢氧化钾;⑥氢氧化铁胶体;⑦硫酸铁溶液;
(1)上述七种物质中,属于电解质的有_______,属于非电解质的有____。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为______________。
(3)除去③中少量②的方法是_______,化学方程式为________________。
(4)现有100mL⑦溶液中含Fe3+5.6g,则溶液中SO42-的物质的量浓度是______。
(5)若在⑥中缓慢加入①的水溶液,产生的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片 5.0 g投入盛有500mL0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如下图的坐标曲线来表示,下列推论错误的是( )
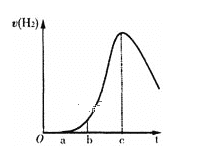
A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.t由b→c段产生氢气的速率增加较快的主要原因之一是反应放热温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要原因是溶液中c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系(反应条件略)。下列说法不正确的是( )
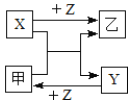
A.甲、乙两种化合物只能通过化合反应得到
B.X既可以是金属元素也可以是非金属元素
C.乙在常温下,既可以是气态也可以是液态、固态
D.若X、Y是非金属元素,则非金属性X比Y强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com