
已知H2B在溶液中的电离方程式:H2B = H++HB-, HB-H++B2-。下列叙述一定正确的是
A. Na2B溶液存在:c(Na+) = 2c (HB-) + 2c(B2-) + 2c(H2B)
B.NaHB溶液一定显酸性
C.HB-的水解方程式:HB-+H2O H2B+OH-
D.NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+ = H2B
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 已知H2B在水溶液中存在以下电离:
已知H2B在水溶液中存在以下电离: H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2- H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性 H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
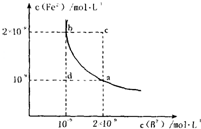
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性 Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三上学期期末考试化学试卷 题型:选择题
已知H2B在溶液中的电离方程式:H2B = H++HB-,
HB- H++B2-。下列叙述一定正确的是
H++B2-。下列叙述一定正确的是
A. Na2B溶液存在:c (Na+) = 2c (HB-) + 2c(B2-) + 2c(H2B)
B.NaHB溶液一定显酸性
C.HB-的水解方程式:HB-+H2O H2B+OH-
H2B+OH-
D.NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+ = H2B
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2B在溶液中的电离方程式:H2B = H++HB-, HB-![]() H++B2-。下列叙述一定正确的是
H++B2-。下列叙述一定正确的是
A. Na2B溶液存在:c (Na+) = 2c (HB-) + 2c(B2-) + 2c(H2B)
B.NaHB溶液一定显酸性
C.HB-的水解方程式:HB-+H2O![]() H2B+OH-
H2B+OH-
D.NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+ = H2B
查看答案和解析>>
科目:高中化学 来源:2011届黑龙江省哈尔滨六中高三上学期期末考试化学试卷 题型:单选题
已知H2B在溶液中的电离方程式:H2B = H++HB-, HB-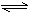 H++B2-。下列叙述一定正确的是
H++B2-。下列叙述一定正确的是
A. Na2B溶液存在:c (Na+) =" 2c" (HB-) + 2c(B2-) + 2c(H2B)
B.NaHB溶液一定显酸性
C.HB-的水解方程式:HB-+H2O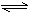 H2B+OH-
H2B+OH-
D.NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+ = H2B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com