
分析 (1)由于n(SO2):n(NaOH)=1:1反应,发生反应:SO2+NaOH=NaHSO3;亚硫酸氢钠溶液呈酸性,说明亚硫酸氢根离子电离程度大于水解程度;以石墨作电极,电解NaHSO3饱和溶液时,只有一个电极产生气体,只能是阴极上氢离子放电生成氢气,阳极是亚硫酸氢根失去电子生成生成硫酸根,结构电荷守恒、原子守恒书写电极反应式;
(2)0.1mol/LNa2SO3溶液中,亚硫酸根离子水解显碱性,氢氧根离子源于亚硫酸根的水解、水的电离等,溶液中氢氧根离子浓度大于亚硫酸氢根,溶液中氢离子浓度等于水电离的氢氧根离子浓度;
Na2SO3溶液放置于空气中一段时间后被氧化为硫酸钠,溶液pH从碱性变化为中性;
(3)常温下实验①测定溶液PH=8,说明溶液呈碱性,H2S2O3是一种弱酸,据此分析判断选项;
实验②发生反应是利用氯气氧化硫代硫酸钠为硫酸钠,硫酸根与钡离子生成硫酸钡沉淀,结合电荷守恒、原子守恒书写离子方程式;
(4)①高锰酸钾溶液是紫红色溶液,反应完毕,滴入的最后一滴高锰酸钾溶液盐酸不褪去;高锰酸钾溶液具有强氧化性,可以腐蚀橡胶管;
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,消耗标准液的体积偏小;
③根据方程式计算Na2S2O3的物质的量,进而计算Na2S2O3•5H2O的质量分数.
解答 解:(1)n(NaOH)=0.1L×1mol/L=0.1mol,故n(SO2):n(NaOH)=1:1,发生反应:SO2+NaOH=NaHSO3,反应的离子方程式为:SO2+OH-=HSO3-;
该溶液pH<7,因有HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-电离程度强于水解程度;
以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,只能是阴极上氢离子放电生成氢气,阳极是亚硫酸氢根失去电子生成生成硫酸根,则阳极的电极反应式为:HSO3-+H2O-2e-=SO42-+3H+;
故答案为:SO2+OH-=HSO3-;因有HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-电离程度强于水解程度;HSO3-+H2O-2e-=SO42-+3H+;
(2)0.1mol/LNa2SO3溶液中,存在平衡:SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,H2O?H++OH-,亚硫酸根离子水解显碱性,氢氧根离子源于亚硫酸根的水解、水的电离等,溶液中氢氧根离子浓度大于亚硫酸氢根,溶液中氢离子浓度等于水电离的氢氧根离子浓度,溶液中离子浓度大小比较为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
Na2SO3溶液放置于空气中一段时间后被氧化为硫酸钠,溶液PH从碱性变化为中性,pH减小,
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);减小;
(3)常温下实验①测定溶液pH=8,说明溶液呈碱性,H2S2O3是一种弱酸.
A.该Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,溶液中氢氧根离子为水电离产生,故水电离的c(OH-)=10-6mol/L,故A错误;
B.Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,证明H2S2O3是一种弱酸,故B正确;
C.Na2S2O3是钠盐是一种强电解质,故C错误;
D.Na2S2O3水解分步进行,反应的离子方程式为S2O32-+H2O?HS2O3-+OH-,HS2O3-+H2O?H2S2O3+OH-,故D错误;
实验②发生反应是利用氯气氧化硫代硫酸钠为硫酸钠,硫酸根离子与钡离子生成硫酸钡沉淀,反应的离子方程式:S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+;
故答案为:B;S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+;
(4)①此滴定实验是用紫红色高锰酸钾溶液滴定硫代硫酸钠溶液,滴入最后一滴溶液呈紫红色,半分钟不褪色,说明滴定到达终点,不需要指示剂,高锰酸钾溶液具有强氧化性,能腐蚀橡胶管,所以使用酸式滴定管;
故答案为:否;酸式;
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,消耗高锰酸钾溶液体积减小,则会使样品中Na2S2O3•5H2O的质量分数的测量结果偏小;
故答案为:偏小;
③设样品中Na2S2O3•5H2O为xmol,则:
5S2O32-+8MnO4-+14H+=8Mn2++10SO42-+7H2O
5 8
n 0.40mol/L×0.02L=0.008mol
n=$\frac{5×0.008mol}{8}$=0.005mol
产品中Na2S2O3•5H2O的质量分数=$\frac{0.005mol×248g/mol}{1.28g}$×100%=96.9%,
故答案为:96.9%.
点评 本题比较综合,涉及与量有关的反应、电解原理、盐类水解应用、离子浓度大小比较、氧化还原反应滴定、物质组成含量的测定等,是对学生综合能力的考查,属于拼合型题目,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③⑤⑥ | C. | ②④⑤⑥ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是烃类化合物 | B. | 常温下呈固态 | ||
| C. | 具有类似金刚石的硬度 | D. | 易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
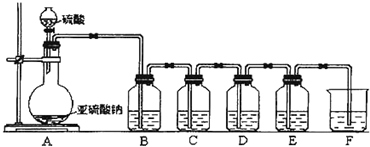
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ④①③②⑤ | C. | ⑤④②①③ | D. | ④③⑤②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第四周期第ⅢA族 | B. | 第六周期第ⅥA族 | C. | 第五周期第ⅥA族 | D. | 第六周期第ⅦA族. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
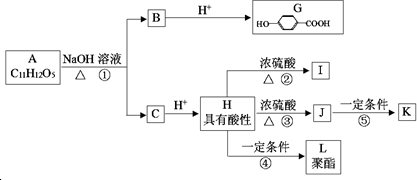
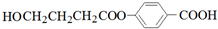 .
. ;⑤n CH2=CHCH2COOH$\stackrel{催化剂}{→}$
;⑤n CH2=CHCH2COOH$\stackrel{催化剂}{→}$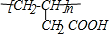 .
.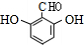 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com