
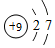 £®
£® £®
£®·ÖĪö A”¢B”¢C”¢D”¢E”¢F”¢GĘßÖÖ¶ĢÖÜĘŚÖ÷×åŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®AŗĶE×īĶā²ćµē×ÓŹżĻąĶ¬£¬¶žÕßĶ¬Ö÷×壬1molµ„ÖŹEøś×ćĮæĖįĶźČ«·“Ó¦Ź±£¬²śÉś±ź×¼×“æöĻĀ11.2LĒāĘų£¬ĒāĘųµÄĪļÖŹµÄĮæŹĒ0.5mol£¬øł¾Ż×ŖŅʵē×ÓĻąµČÖŖ£¬EŹĒµŚIA×åŌŖĖŲ£¬C2-ÓėE+¾ßÓŠĻąĶ¬µÄµē×Ó²ć½į¹¹£¬ĖłŅŌCĪŖO£¬EĪŖNa£¬AĪŖH»ņLi£»B”¢CŗĶFŌŚÖÜĘŚ±ķÖŠĻąĮŚ£¬B”¢CĶ¬ÖÜĘŚ£¬C”¢FĶ¬Ö÷×壬ĖłŅŌBĪŖN£¬FĪŖS£¬DĪŖF£¬A”¢B”¢C”¢D”¢E”¢F”¢GĪŖĘßÖÖ¶ĢÖÜĘŚÖ÷×åŌŖĖŲµÄŌ×Ó£¬ĖłŅŌGĪŖCl£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗ£Ø1£©A”¢B”¢C”¢D”¢E”¢F”¢GĘßÖÖ¶ĢÖÜĘŚÖ÷×åŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®AŗĶE×īĶā²ćµē×ÓŹżĻąĶ¬£¬¶žÕßĶ¬Ö÷×壬1molµ„ÖŹEøś×ćĮæĖįĶźČ«·“Ó¦Ź±£¬²śÉś±ź×¼×“æöĻĀ11.2LĒāĘų£¬ĒāĘųµÄĪļÖŹµÄĮæŹĒ0.5mol£¬øł¾Ż×ŖŅʵē×ÓĻąµČÖŖ£¬EŹĒµŚIA×åŌŖĖŲ£¬C2-ÓėE+¾ßÓŠĻąĶ¬µÄµē×Ó²ć½į¹¹£¬ĖłŅŌCĪŖO£¬EĪŖNa£¬ÄĘŌŖĖŲŌ×ÓŗĖĶāµē×ÓÅŲ¼ĪŖ£ŗ1s22s22p63s1£¬Ō×ÓŗĖĶāÓŠ3øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ1£¬“¦ÓŚÖÜĘŚ±ķÖŠµŚČżÖÜĘŚIA×壬
¹Ź“š°øĪŖ£ŗµŚČżÖÜĘŚIA×壻
£Ø2£©B”¢CŗĶFŌŚÖÜĘŚ±ķÖŠĻąĮŚ£¬B”¢CĶ¬ÖÜĘŚ£¬C”¢FĶ¬Ö÷×壬ĖłŅŌBĪŖN£¬FĪŖS£¬DĪŖF£¬FĪŖ9ŗÅŌŖĖŲ£¬Ō×ÓŗĖÖŠÓŠ9øöÖŹ×Ó£¬ŗĖĶā9øöµē×Ó£¬ĘäŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ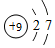 £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ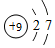 £»
£»
£Ø3£©EĪŖNa£¬FĪŖS£¬E2FĪŖNa2S£¬Įņ»ÆÄĘĪŖĄė×Ó»ÆŗĻĪļ£¬ÓƵē×ÓŹ½±ķŹ¾Na2SµÄŠĪ³É¹ż³ĢĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø4£©FµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄÅØČÜŅŗĪŖÅØĮņĖį£¬ĶÓėÅØĮņĖįŌŚ¼ÓČČĢõ¼žĻĀ·“Ӧɜ³ÉĮņĖįĶ”¢¶žŃõ»ÆĮņŗĶĖ®£¬·“Ó¦µÄ·½³ĢŹ½ĪŖ£ŗCu+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$CuSO4+SO2”ü+2H2O£¬
¹Ź“š°øĪŖ£ŗCu+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$CuSO4+SO2”ü+2H2O£»
£Ø5£©A”¢B”¢GČżÖÖŌŖĖŲĮ½Į½×éŗĻŠĪ³ÉµÄ»ÆŗĻĪļŌŚæÕĘųÖŠĻąÓöŠĪ³É°×ŃĢ£¬ŌņČżÖÖŌŖĖŲĪŖH”¢N”¢Cl£¬ČżÖÖŌŖĖŲĮ½Į½×éŗĻŠĪ³ÉµÄ»ÆŗĻĪļŌŚæÕĘųÖŠĻąÓöŠĪ³É°×ŃĢ£¬ŹĒ°±ĘųÓėHCl·“Ӧɜ³ÉĀČ»Æļ§£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗNH3+HClØTNH4Cl£¬ĀČ»Æļ§ÓÉļ§øłĄė×ÓŗĶĀČĄė×Ó¹¹³É£¬ŗ¬ÓŠĄė×Ó¼ü£¬ļ§øłĄė×ÓŹĒÓÉNH3ŗĶH+ŅŌÅäĪ»¼ü½įŗĻ¶ų³É£¬ĖłŅŌĄė×ÓÖŠ“ęŌŚ¹²¼Ū¼üŗĶÅäĪ»¼ü£¬ĖłŅŌøĆ»ÆŗĻĪļÖŠ“ęŌŚµÄ»Æѧ¼üĄąŠĶÓŠĄė×Ó¼ü”¢¹²¼Ū¼ü”¢ÅäĪ»¼ü£¬
¹Ź“š°øĪŖ£ŗĄė×Ó¼ü”¢¹²¼Ū¼ü”¢ÅäĪ»¼ü£»
£Ø6£©PŗĶQĮ½ÖÖĪļÖŹ¶¼ŹĒÓÉH”¢O”¢Na”¢SĖÄÖÖŌŖĖŲ×é³ÉµÄŃĪ£¬ĘäĖ®ČÜŅŗ¶¼ĻŌĖįŠŌ£¬Ó¦ŹĒNaHSO3ÓėNaHSO4£¬¶žÕßµČĪļÖŹµÄĮæĒ”ŗĆĶźČ«·“Ó¦£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗH++HSO3-=SO2”ü+H2O£¬
¹Ź“š°øĪŖ£ŗH++HSO3-=SO2”ü+H2O£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²é½į¹¹ŠŌÖŹĪ»ÖĆ¹ŲĻµÓ¦ÓĆ£¬ĶʶĻŌŖĖŲŹĒ½āĢā¹Ų¼ü£¬²ąÖŲ¶ŌŌŖĖŲÖÜĘŚĀÉŅŌ¼°»ÆѧÓĆÓļµÄ漲飬ĢāÄæÄѶČÖŠµČ£®


 Ņ»±¾ŗĆĢāæŚĖćĢāæØĻµĮŠ“š°ø
Ņ»±¾ŗĆĢāæŚĖćĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 5sŹ±£¬Õż”¢Äę·“Ó¦ĖŁĀŹ¶¼“ļµ½×ī“ó | |
| B£® | Ē°5sÄŚĘ½¾ł·“Ó¦ĖŁĀŹ¦Ō£ØY£©=0.1 mol/£Ø L•s£© | |
| C£® | “ļĘ½ŗāŹ±£¬ø÷ĪļÖŹµÄÅØ¶Č¶¼±£³Ö²»±ä£¬·“Ó¦Ķ£Ö¹ | |
| D£® | ÉżøßĪĀ¶Č£¬²āµĆČŻĘ÷ÖŠĆÜ¶Č²»±äŹ±£¬±ķŹ¾øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ļņŗ¬ÓŠ1mol AlCl3µÄČÜŅŗÖŠ¼ÓČė×ćĮæNaOHČÜŅŗ¾Ķ»į²śÉś78g °×É«³Įµķ | |
| B£® | 1 mol O2Óė½šŹōNa³ä·Ö·“Ó¦£¬×ŖŅʵē×ӵďżÄæĪŖ4 NA | |
| C£® | Ļņ0.1molµÄĢ¼Ėį¼Ų¹ĢĢåÖŠ»ŗ»ŗµĪ¼Ó0.2molµÄĻ”ŃĪĖį»į²śÉś2.24LµÄCO2ĘųĢå | |
| D£® | ±ź×¼×“æöĻĀ£¬ÓĆŅ»³äĀśøÉŌļHClĘųĢåµÄÉÕĘæ×öÅēČŖŹµŃ飬µ±Ė®³äĀśÕūøöÉÕĘæŗó£Ø¼ŁÉčČÜŅŗ²»ĶāŅē£©£¬ÉÕĘæÄŚŃĪĖįµÄĪļÖŹµÄĮæµÄÅضČĪŖ$\frac{1}{22.4}$mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Óɱ»Ńõ»ÆµÄŌŖĖŲ×é³ÉµÄ·“Ó¦ĪļŹĒŃõ»Æ¼Į | |
| B£® | ŌŚŅ»øöŃõ»Æ»¹Ō·“Ó¦ÖŠ£¬Ńõ»Æ·“Ó¦ŗĶ»¹Ō·“Ó¦Ķ¬Ź±·¢Éś | |
| C£® | ÓÉ»ÆŗĻĢ¬×Ŗ±äĪŖÓĪĄėĢ¬µÄ±ä»ÆŅ»¶ØŹĒ»¹Ō·“Ó¦ | |
| D£® | Ńõ»Æ»¹Ō·“Ó¦µÄŹµÖŹŹĒŌŖĖŲ»ÆŗĻ¼ŪµÄÉż½µ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĶØČė¹żĮæCl2£ŗCl-”¢Fe2+”¢SO42-”¢Al3+ | |
| B£® | ¼ÓČė¹żĮæNaOHČÜŅŗ£ŗNa+”¢AlO2-”¢SO42-”¢OH- | |
| C£® | ¼ÓČė¹żĮæ°±Ė®£ŗNa+”¢NH4+”¢SO42-”¢AlO2- | |
| D£® | ¼ÓČė¹żĮæĶ·Ū£ŗNO3-”¢Fe3+”¢SO42-”¢Al3+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2SŗĶNH3¾łŹĒ¼Ūµē×Ó×ÜŹżĪŖ8µÄ¼«ŠŌ·Ö×Ó | |
| B£® | HS-ŗĶHCl¾łŹĒŗ¬Ņ»øö¼«ŠŌ¼üµÄ18µē×ÓĮ£×Ó | |
| C£® | CH2Cl2ŗĶCCl4¾łŹĒĖÄĆęĢå¹¹ŠĶµÄ·Ē¼«ŠŌ·Ö×Ó | |
| D£® | SO2ŗĶSO3Ą“»Æ¹ģµĄĄąŠĶ¾łĪŖsp2Ōӻƣ¬æռ乹ŠĶ·Ö±šĪŖVŠĪ”¢Ę½ĆęČż½ĒŠĪ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğĖÄ“ØŹ”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠ¹ŲÓŚČČ»Æѧ·“Ó¦µÄĆčŹöÖŠÕżČ·µÄŹĒ
A£®HClŗĶNaOH·“Ó¦µÄÖŠŗĶČČ”÷H£½£57.3kJ/mol£¬ŌņH2SO4ŗĶCa(OH)2·“Ó¦µÄÖŠŗĶČČĪŖ2”Į£Ø£57.3£©kJ/mol
B.500”ę”¢30MPa ĻĀ£¬½«0.5molN2ŗĶ1.5mol H2ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3(g)£¬·ÅČČ19.3kJ£¬ĘäČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2(g)+3H2(g)
ĻĀ£¬½«0.5molN2ŗĶ1.5mol H2ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3(g)£¬·ÅČČ19.3kJ£¬ĘäČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2(g)+3H2(g) 2NH3(g) ”÷H=-38.6kJ”¤m
2NH3(g) ”÷H=-38.6kJ”¤m ol-1
ol-1
C£®CO(g)µÄČ¼ÉÕČČŹĒ283.0 kJ/mol£¬Ōņ±ķŹ¾COČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖCO(g)£«1/2O2(g)=CO2 (g)£»”÷H£½£283.0 kJ/mol
D£®ŠčŅŖ¼ÓČČ²ÅÄÜ·¢ÉśµÄ·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com