
 ,反应的化学方程式为
,反应的化学方程式为 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$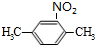 +H2O.
+H2O. 分析 (1)根据密度之比等于相对分子质量之比计算芳香烃的相对分子质量,结合碳元素质量分数计算C原子数目,进而计算H原子数目,确定分子式;
(2)该烃苯环上有两个支链,且硝化时,苯环上的一硝基取代物有一种,说明苯环环上2个相同的取代基处于对位.
解答 解:(1)芳香烃的相对分子质量为29×3.66=106,分子中含C原子的个数为$\frac{106×90.6%}{12}$=8,含H原子的个数为:$\frac{106-12×8}{1}$=10,所以分子式为C8H10,属于苯的同系物,
故答案为:C8H10;同系物;
(2)若该烃苯环上有两个支链,且硝化时,苯环上的一硝基取代物有一种,则该烃的结构简式可能为  ,反应的化学方程式为:
,反应的化学方程式为: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: ;
; +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.
点评 本题考查有机物分子式与结构的确定、同分异构体等,比较基础,掌握燃烧法利用原子守恒确定有机物分子式.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | 饱和食盐水$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{H_{2}O+O_{2}}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
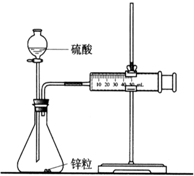 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com