
【题目】甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)![]() CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为______。
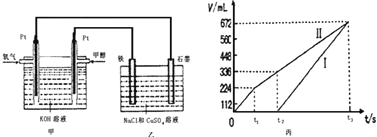
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为_____________mol。
(4)写出甲中通入甲醇这一极的电极反应式______________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为___________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_____________g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____________克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
【答案】CH3OH(l)+3/2 O2(g)== CO2(g)+2H2O(l)ΔH=(2Q1+3Q2+2Q3)kJmol-1 3Cl2+2NH4++8OH-=N2↑+6Cl-+8H2O 5×10-4 CH3OH-6e-+8OH-=CO32-+6H2O 4OH--4e-=O2↑+2H2O 0.1 1.28 0.016
【解析】
(1)依据热化学方程式和盖斯定律计算分析得到所需热化学方程式;
(2)可以根据反应物和生成物正确书写化学方程式;
(3)依据离子方程式的定量关系计算生成硫酸根离子的量;
(4)在燃料电池的中,负极上是燃料发生失电子的氧化反应,根据电解质环境来书写电极反应式;
(5)根据电解池的电极反应规律来书写电解反应,结合电子守恒和离子的量的关系进行计算;
(6)根据n=![]() 计算出氧气的物质的量,再根据丙中图象判断铜离子的总物质的量,最后根据m=nM计算出生成铜的质量;
计算出氧气的物质的量,再根据丙中图象判断铜离子的总物质的量,最后根据m=nM计算出生成铜的质量;
(7)根据Q=It和N=Q/e-结合CH3OH-6e-+8OH-=CO32-+6H2O计算。
(1)根据盖斯定律,将已知热化学方程式中的氢气和水蒸气消去,得到1mol甲醇完全燃烧生成二氧化碳气体和液态水的热化学方程式是CH3OH(l)+3/2 O2(g)== CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJmol-1;
(2)铵根离子,可在碱性条件下通入氯气,反应生成氮气,可知氯气被还原为Cl-,同时应该有水生成,发生反应的离子方程式为3Cl2+2NH4++8OH-=N2↑+6Cl-+8H2O;
(3)1molS2O32-被氧化为SO42-转移8mol电子,过量的氯气为1×10-3mol,完全被还原转移电子为2×10-3mol,故参加反应的S2O32-为![]() =0.25×10-3mol,生成的SO42-为0.25×10-3mol×2=0.5×10-3mol;
=0.25×10-3mol,生成的SO42-为0.25×10-3mol×2=0.5×10-3mol;
(4)在燃料电池的中,负极上是燃料发生失电子的氧化反应,在碱性环境下,甲醇失电子的过程为:CH3OH-6e-+8OH-=CO32-+6H2O;
(5)石墨为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=![]() ×2=0.02mol,所以c(NaCl)==0.1mol/L;
×2=0.02mol,所以c(NaCl)==0.1mol/L;
(6)标况下的氧气336mL的物质的量为![]() =0.015mol,转移电子数为0.015mol×4=0.06mol;阴极析出铜的物质的量为
=0.015mol,转移电子数为0.015mol×4=0.06mol;阴极析出铜的物质的量为![]() =0.02mol,质量为0.02mol×64g·mol-1=1.28g;
=0.02mol,质量为0.02mol×64g·mol-1=1.28g;
(7)电解装置的电流强度达到5.0A,每分钟转移电子的物质的量为![]() =0.003mol,负极通入气体的质量为
=0.003mol,负极通入气体的质量为![]() ×32g·mol-1=0.016g。
×32g·mol-1=0.016g。


科目:高中化学 来源: 题型:
【题目】在120 ℃时,以任意质量比混合的某烃的混合物和过量 O2 在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是( )
A.CH4和C2H4B.CH4和C2H6C.C2H4和C2H6D.C2H2和C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用![]() 与
与![]() 制取
制取![]() 气体,再由
气体,再由![]() 在强碱性条件下与过量的
在强碱性条件下与过量的![]() 反应制得漂白剂
反应制得漂白剂![]() 装置如图1所示
装置如图1所示![]() .
.
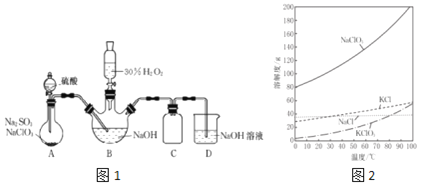
已知![]() 如图
如图![]() :
:![]() 饱和溶液在温度低于
饱和溶液在温度低于![]() 时析出的晶体是
时析出的晶体是![]() ,高于
,高于![]() 时析出晶体是
时析出晶体是![]() ;
;![]() Ⅱ
Ⅱ![]()
![]() 超过
超过![]() 时会完全分解;
时会完全分解;![]() Ⅲ
Ⅲ![]() 高于
高于![]() 时
时![]() 分解成
分解成![]() 和NaCl.
和NaCl.
![]() 图1装置A发生的反应中,还原剂是______.
图1装置A发生的反应中,还原剂是______.
![]() 图1装置B中反应生成
图1装置B中反应生成![]() 的化学方程式为______.
的化学方程式为______.
![]() 实验中图1装置B需进行温度控制不超过
实验中图1装置B需进行温度控制不超过![]() ,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有______、______.
,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有______、______.
![]() 请补充从图1装置B反应后的溶液中获得
请补充从图1装置B反应后的溶液中获得![]() 晶体的操作步骤.
晶体的操作步骤.
![]() 在
在![]() 时蒸发结晶;
时蒸发结晶;![]() ______;
______;![]() ______;
______;![]() ______;得到成品.
______;得到成品.
![]() 图1装置C的作用是______.
图1装置C的作用是______.
![]() 证明实验后图1装置B所得混合溶液中的
证明实验后图1装置B所得混合溶液中的![]() 具有氧化性的实验方案是______
具有氧化性的实验方案是______![]() 可供选用的试剂:稀
可供选用的试剂:稀![]() 、
、![]() 溶液、KSCN溶液
溶液、KSCN溶液![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )
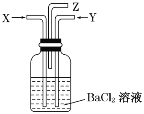
A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾中含有多种污染物,包括氮氧化物![]() 、CO、
、CO、![]() 等。它们可以通过化学反应得到一定的消除或转化。
等。它们可以通过化学反应得到一定的消除或转化。
![]() 氮硫的氧化物的转化:
氮硫的氧化物的转化: ![]()
已知:![]()
![]()
![]() ,则
,则![]() _______
_______![]() 。
。
一定条件下,将![]() 与
与![]() 以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有_______。
以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有_______。
![]() 混合气体的密度不变
混合气体的密度不变 ![]() 混合气体的颜色保持不变
混合气体的颜色保持不变
![]() 和NO的体积比保持不变
和NO的体积比保持不变 ![]() 反应速率
反应速率![]()
![]() 碳氧化物的转化:
碳氧化物的转化:
![]() 可用于合成甲醇,反应方程式为:
可用于合成甲醇,反应方程式为:![]() ,在一恒温恒容密闭容器中充入
,在一恒温恒容密闭容器中充入![]() 和
和![]() 进行上述反应。测得CO和
进行上述反应。测得CO和![]() 浓度随时间变化如图1所示。
浓度随时间变化如图1所示。

则![]() 内,氢气的反应速率为____
内,氢气的反应速率为____![]() 第
第![]() 后,保持温度不变,向该密闭容器中再充入
后,保持温度不变,向该密闭容器中再充入![]() 和
和![]() ,则平衡_______
,则平衡_______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。
![]() 通过电解CO制备
通过电解CO制备![]() ,电解液为碳酸钠溶液,工作原理如图2所示,写出阴极的电极反应式_____。若以甲醇燃料电池作为电源,则生成标准状况下
,电解液为碳酸钠溶液,工作原理如图2所示,写出阴极的电极反应式_____。若以甲醇燃料电池作为电源,则生成标准状况下![]() 需要消耗
需要消耗![]() 的质量为_______。
的质量为_______。

![]() 硫氧化物的转化:硫的氧化物与一定量氨气、空气反应,可生成硫酸铵。硫酸铵水溶液呈酸性的原因是________________
硫氧化物的转化:硫的氧化物与一定量氨气、空气反应,可生成硫酸铵。硫酸铵水溶液呈酸性的原因是________________![]() 用离子方程式表示
用离子方程式表示![]() 室温时,向
室温时,向![]() 溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:
溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:![]() ____
____![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1996年人工合成了第112 号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
B.Na、Al、Cu可以分别用热还原法、热分解法和电解法冶炼得到
C.铜、冰醋酸、酒精分别属于强电解质、弱电解质、非电解质
D.煤的气化与液化均属于化学变化,煤的干馏属于物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
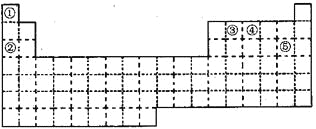
【题目】①~⑤五种元素在元素周期表中的位置如下图所示:
回答下列问题:
(1)①~⑤五种元素中,非金属性最强的元素在周期表中的位置是___________;
(2)②③④元素原子中,半径最小的是_________(填元素符号);
(3)元素①和③可以形成众成多的化合物,其中最简单的是_____(化学式)。该化合物中,化学键的类型为_________(选填“极性共价键”、 “非极性共价键”或“离子键”);
(4)元素④的最高价氧化物对应水化物能与其最低价的气态氢化物发生反应,产物是________(化学式);
(5)元素⑤单质与水反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关,下列有关说法正确的是![]()
![]()
A.我国在南海成功开采的可燃冰![]() 可能会带来酸雨等环境污染
可能会带来酸雨等环境污染
B.大量使用含丙烷、二甲醚等辅助成分的“空气清新剂”,会对环境造成新的污染
C.在人体内酶的作用下,纤维素可以发生水解反应生成葡萄糖
D.我国全面启动的北斗导航系统的信号传输与硅有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A.工夫茶主要程序有治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶等其中涉及的操作方法有:溶解、萃取、过滤、蒸馏
B.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成![]() 和
和![]()
C.工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料
D.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阴极保护法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com