

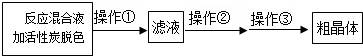
分析 Ⅰ.(1)制备二氧化硫用中等浓度的硫酸;
(2)Na2S2O3溶液中通入过量的二氧化硫发生反应生成单质硫和亚硫酸氢钠;
(3)硫代硫酸钠的溶解度随温度的升高而降低,为减少损失,除去不溶性杂质需要趁热过滤,滤液通过蒸发浓缩、冷却结晶、抽滤、洗涤、干燥得到晶体;
Ⅱ.(4)依据化学方程式中的定量关系计算,2Na2S2O3+I2=2NaI+Na2S4O6;
(5)滴定过程中误差分析可以依据C(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析,错误操作全部归为标准溶液体积的变化判断产生的误差;
(6)取反应后的溶液少许滴入盛有10mL 0.1mol/L FeCl3溶液的小烧杯,溶液呈现血红色,说明生成了SCN-.
解答 解:Ⅰ.(1)二氧化硫易溶于水,所以不能用稀酸,浓硫酸中氢离子浓度很小,不利于与亚硫酸钠固体反应,所以制备二氧化硫用中等浓度的硫酸选C,
故答案为:C;
(2)pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色混浊,反应的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O,所以溶液pH要控制不小于7,反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热.如果通入SO2过量,发生的化学反应方程式为Na2S2O3+SO2+H2O=2NaHSO3+S↓,
故答案为:Na2S2O3+SO2+H2O=2NaHSO3+S↓;
(3)由于硫代硫酸钠的溶解度随温度的升高而降低,除去不溶性杂质,所以操作I应该是趁热过滤,其目的是趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质,操作②是溶液中获得溶质晶体的操作为蒸发浓缩,冷却结晶、抽滤、洗涤、干燥,得到粗晶体,
故答案为:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质; 蒸发浓缩,冷却结晶;
Ⅱ.(4)取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液 mL,结合化学方程式定量关系计算,
2Na2S2O3+I2=2NaI+Na2S4O6
2 1
n 0.010mol/L×v mL×1000L/ml
n=20vmol,
得到样品纯度=$\frac{20vmol×248g/mol}{ag}$×100%=$\frac{4960v}{a}$×100%,
故答案为:$\frac{4960v}{a}$×100%;
(5)A.锥形瓶未用Na2S2O3溶液润洗,消耗标准溶液体积增大,测定结果偏高,故A错误;
B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数,滴定可能为达到反应终点,消耗标准溶液体积减小,测定结果偏低,故B正确;
C.滴定终点时仰视读数,读取标准溶液体积增大,测定结果偏高,故C错误;
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡读取标准溶液体积减小,测定结果偏低,故D正确;
故答案为:BD;
Ⅲ.向装有2mL 0.1mol/L 的NaCN溶液的试管中滴加2mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10mL 0.1mol/L FeCl3溶液的小烧杯,溶液呈现血红色,说明生成SCN-离子,Na2S2O3解毒反应的离子反应方程式为:CN-+S2O32-=SCN-+SO32-,
故答案为:CN-+S2O32-=SCN-+SO32-.
点评 本题以实验探究的方式考查物质的分离和提纯方面的知识,属于综合知识的考查,注意知识的归纳和梳理是解题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:
实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
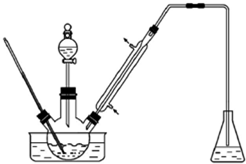 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl固体(KNO3)溶解配成热饱和溶液、降温结晶 | |
| B. | CO(水蒸气)通过浓硫酸的洗气瓶 | |
| C. | CaO固体(CaCO3)高温煅烧 | |
| D. | KCl固体(MnO2)溶解、过滤、蒸发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com