
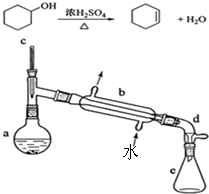
 ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�ã��гּ����Ȳ�����ʡ�ԣ���ͼ��
ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�ã��гּ����Ȳ�����ʡ�ԣ���ͼ��| ��Է������� | �ܶ� | �е� | �ܽ��� | |
| ���Ҵ� | 100 | 0.9618 | 161 | ����ˮ |
| ����ϩ | 82 | 0.8102 | 83 | ������ˮ |
 ��
������ ��1�������������������ܣ����Ƭ�ܷ�ֹҺ�屩�У�
��2�����ȹ����У����������ɷ�����ȥ��Ӧ���ɻ���ϩ�⣬�����Է���ȡ����Ӧ��
��3����Һ©����ʹ��ǰ�����©������ϩ���ܶ�С��ˮ����ˮ���ϲ㣬��Һʱ�ϲ�Һ��Ҫ�ӷ�Һ©���� �Ͽڵ�����
��4����Ӧ��ֲ��������������ᣬҪ��Na2CO3��Һ��ȥ����ˮ�Ȼ��ƾ�����ˮ�ԣ�
��5������ϩ�����ʵ���=$\frac{20g}{100g/mol}$=0.2mol�������Ͽ��Եõ�0.2mol����ϩ��������=0.1mol��82g/mol=16.4g���ݴ˼�������ʣ�
��� �⣺��1�������������������ܣ�Һ���ڼ��ȹ������ײ���������������ɰ�ȫ�¹ʣ����Ƭ�ܷ�ֹҺ�屩�У��Ӷ����ٰ�ȫ������
�ʴ�Ϊ�������ܣ������У�
��2���ȹ����У����������ɷ�����ȥ��Ӧ���ɻ���ϩ�⣬�����Է���ȡ����Ӧ�����Ӽ䷢����ˮ��Ӧ���ɶ������ѣ���ṹ��ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��3����Һ©����ʹ��ǰ�����©������ϩ���ܶ�С��ˮ����ˮ���ϲ㣬��Һʱ�ϲ�Һ��Ҫ�ӷ�Һ©���� �Ͽڵ�����
�ʴ�Ϊ����©���Ͽڣ�
��4����Ӧ��ֲ��������������ᣬҪ��Na2CO3��Һ��ȥ����ˮ�Ȼ��ƾ�����ˮ�ԣ����Լ���Na2CO3��Һ��Ŀ���� ��ȥ�����H2SO4��������ˮCaCl2�������Ǹ������û���ϩ��
�ʴ�Ϊ����ȥ�����H2SO4���������û���ϩ��
��3����ˮ�Ȼ��ƾ�����ˮ�ԣ������ղ�Ʒ�е�ˮ�ֶ�������������뻥�ܵ�Һ���������ķ������룬�������ͻ���ϩ�ܻ����ҷе����ϴ��Ը�����е㲻ͬ��������ķ������룬�ʴ�Ϊ������ˮ�֣�����
��4������ϩ�����ʵ���=$\frac{20g}{100g/mol}$=0.2mol�������Ͽ��Եõ�0.2mol����ϩ��������=0.1mol��82g/mol=16.4g�������=$\frac{12.30g}{16.4g}$��100%=75%��
�ʴ�Ϊ��75%��
���� ���⿼�����Ʊ�ʵ�鷽����ƣ���ȷ��Ӧԭ���ǽⱾ��ؼ����������ʵ����ʡ�ʵ����������淶�����ʷ�����ᴿ������ѡȡ��֪ʶ�������������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 +Br2$\stackrel{Fe}{��}$
+Br2$\stackrel{Fe}{��}$ +HBr��
+HBr���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ʵ�����Ʊ�1��2-��������ķ�Ӧԭ�����£�
ʵ�����Ʊ�1��2-��������ķ�Ӧԭ�����£�| �Ҵ� | 1��2-�������� | ���� | |
| ״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
| �ܶ�/g•cm-3 | 0.79 | 2.2 | 0.71 |
| �е�/�� | 78.5 | 132 | 34.6 |
| �۵�/�� | һl30 | 9 | -1l6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʪ�� | ǿ���Խ����У�Fe��NO3��3��NaClO��Ӧ�����Ϻ�ɫ����������Һ |
| �ɷ� | Fe2O3��KNO3��KOH��ϼ��ȹ��������Ϻ�ɫ�������κ�KNO2�Ȳ��� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com