
| A. | 石油的催化重整是获得芳香烃的主要途径 | |
| B. | 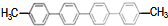 苯环上的一氯代物有4种 苯环上的一氯代物有4种 | |
| C. | 燃烧等质量的甲烷和丙烯,丙烯需要的O2更多 | |
| D. | 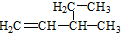 命名为3-甲基-1-戊烯 命名为3-甲基-1-戊烯 |
分析 A.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量;裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯等气态烯烃;
石油的催化重整可以获得芳香烃;
B.结构对称,苯环上4种H、甲基上一种H;
C.等质量的甲烷(CH4)和丙烯(最简式为CH2),含H越大,消耗氧气越多;
D.含碳碳双键的主链有5个碳,双键在1、2号碳上,3号C上有甲基.
解答 解:A.由石油的综合利用可知,石油的催化重整是获得芳香烃的主要途径,故A正确;
B.结构对称,苯环上4种H、甲基上一种H,则苯环上的一氯代物有4种,故B正确;
C.等质量的甲烷(CH4)和丙烯(最简式为CH2),含H越大,消耗氧气越多,则甲烷需要的O2更多,故C错误;
D.含碳碳双键的主链有5个碳,双键在1、2号碳上,3号C上有甲基,则名称为3-甲基-1-戊烯,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质为解答的关键,侧重分析与应用能力的考查,注意石油综合利用计有机物燃烧规律等,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1molCu和足量热浓硫酸反应可生成22.4LSO2气体 | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.2mol氧气转移的电子数为0.2NA | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③④ | C. | ①② | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
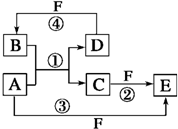 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液刻蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 铜溶于稀HNO3溶液:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶胞是晶体的最小的结构重复单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都属于该晶胞 | |
| D. | 已知晶胞的组成不能推知晶体的组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
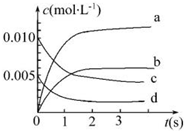 在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com