
|
20℃时,向50.0 mL 1.00 mol/L的Na2CO3溶液中逐滴滴加75.0 mL 1.00 mol/L的盐酸,在液面上收集所产生的气体,收集的气体经干燥后换算成标准状况下的体积为 | |
A. |
840 mL |
B. |
560 mL |
C. |
小于840 mL,大于560 mL |
D. |
略小于560 mL |
科目:高中化学 来源: 题型:
 物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向1L正庚烷中加入(t-BuNO)20.50mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1L).下列说法正确的是( )
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向1L正庚烷中加入(t-BuNO)20.50mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1L).下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省江门市高三一模理综化学试卷(解析版) 题型:填空题
磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。
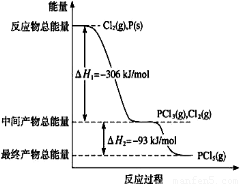
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是???????? ?????????????????????? ???? 。
②P和Cl2分两步反应生成1 mol PCl5的△H3=???? 。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
①反应在50~150s 内的平均速率v(PCl3)=???????????? 。
②试计算该温度下反应的平衡常数(写出计算过程,保留2位有效数字)
(3)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。
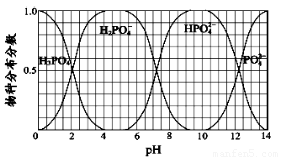
①为获得较纯的Na2HPO4,pH应控制在?????? ;pH=6时,溶液中主要含磷物种浓度大小关系为:??????? ????????????????????????????????????? ??? 。
②Na2HPO4溶液呈碱性,加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从离子平衡角度分析)???????????????????????????????????????????????????????? ?????? 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2 2(t-BuNO)。在20℃时,向1 L正庚烷中加入(t-BuNO)2 0.50
mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1 L)。下列说法正确的是
2(t-BuNO)。在20℃时,向1 L正庚烷中加入(t-BuNO)2 0.50
mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1 L)。下列说法正确的是
A.反应在前10 min内的平均速率为ν(t-BuNO)=0.0325 mol·L-1·min-1
B.保持其他条件不变,若此时再向溶液中加入0.50 mol (t-BuNO)2,重新达平衡时(t-BuNO)2的百分含量减小
C.保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率小于65%
D.保持其他条件不变,升高温度, (t-BuNO)2的平衡转化率大于65%,则其能量关系可用下图表示

查看答案和解析>>
科目:高中化学 来源:2014届江西省高二上学期期末考试化学试卷(解析版) 题型:选择题
温度为T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测得部分数据见下表:

下列说法正确的是 ( )
A.反应在前50 s 的平均速率v (PCl3) =" 0." 0032 mol·L-1·s-1
B.其他条件不变,升高温度,达新平衡时c (PCl3) =" 0." 11 mol·L-1 ,则反应的△H<0
C.相同温度下,起始时向容器中充入2. 0 mol PCl3和2. 0 mol Cl2 ,达到平衡时,PCl3
的转化率小于80%
D.相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3和0. 20 mol Cl2 ,反应达到平衡前v(正) > v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com