
分析 (1)配制240mL 0.2mol•L-1 的Na2CO3溶液,应选择250mL容量瓶,依据m=CVM计算需要溶质的质量;
(2)依据配制一定物质的量浓度一般步骤排序;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差判断;
(4)硫酸过量,碳酸钠完全反应生成二氧化碳,根据n=cV计算碳酸钠的物质的量,根据碳原子守恒计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳的体积;根据c=$\frac{n}{V}$计算反应后钠离子的浓度.
解答 解:(1)配制240mL 0.2mol•L-1 的Na2CO3溶液,应选择250mL容量瓶,需要Na2CO3•10H2O的质量=0.2mol×0.25L×276g/mol=14.3g;
故答案为:14.3;
(2)配制一定物质的量浓度一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的顺序为:BCAFED;
故答案为:BCAFED;
(3)所选用的溶质已经变质,部分已失去了结晶水,导致溶质的物质的偏大,溶液浓度偏高,故选;
B.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
C.将未冷却的溶液沿玻璃棒注入容量瓶中,冷却后溶液体积偏小,溶液浓度偏高,故选;
D.定容时,仰视刻度线导致溶液体积偏大,溶液浓度偏低,故不选;
E.称量时误操作为“左码右物”,依据左盘质量=右盘质量=游码质量,实际称取固体质量=14g-0.3g=13.7g,称取的溶质的质量偏小,溶质的物质的量偏小,溶液浓度偏低,故不选;
F.定容后使溶液混匀静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
故选:AC;
(4)125mL0.2mol/LNa2CO3溶液中碳酸钠的物质的量=0.125L×0.2mol/L=0.025mol,125mL 0.3mol•L-1 的硫酸溶液中硫酸的物质的量=0.125L×0.3mol/L=0.0375mol,故硫酸过量,碳酸钠完全反应生成二氧化碳,由碳原子守恒可知二氧化碳的物质的量为0.025mol,体积为0.025mol×22.4L/mol=0.56L,即560mL;
反应后溶液中钠离子物质的量不变,为0.025mol×2=0.05mol,故钠离子的物质的量浓度=$\frac{0.05mol}{0.25L}$=0.2mol/L,
故答案为:560; 0.2 mol/L.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和步骤是解题关键,注意误差分析的方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入酸性KMnO4溶液中,溶液的紫色褪去 | |
| B. | 乙烯与乙醇在浓硫酸作用下共热反应生成乙酸乙酯 | |
| C. | 苯与溴水混合振荡,溴水层的颜色变浅 | |
| D. | 苯与氢气在一定条件下反应生成环已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:
已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃棒 | B. | 胶头滴管 | C. | 托盘天平 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献.关于如图
原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献.关于如图| A. | 将电能转化为化学能的装置 | B. | 电子由铜片经导线流向锌片 | ||
| C. | 锌片为负极,发生氧化反应 | D. | 铜片上发生的反应为Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
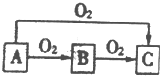 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物)
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com