
| A. | 阿伏加德罗常数就是6.02×1023 | |
| B. | 物质的量是一物理量,表示含有一定数目粒子的集体 | |
| C. | 摩尔是七个基本物理量之一 | |
| D. | 摩尔既是物质的量的单位,又是粒子的数量单位 |
科目:高中化学 来源: 题型:填空题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
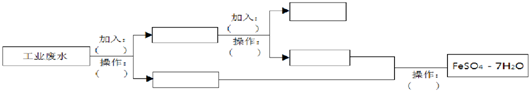
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,这样的排布遵循了泡利原理和洪特规则.
,这样的排布遵循了泡利原理和洪特规则. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤和方法 | 实验现象 |
| ①把6瓶液体分别依次标号A、B、C、D、E、F,然后闻气味 | 只有F没有气味 |
| ②各取少量于试管中,加水稀释 | 只有C、D、E不溶解而浮在水面上 |
| ③分别取少量6种液体于试管中,加新制Cu(OH)并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com