
| A. | 两种溶液pH的大小顺序是②>① | |
| B. | 若将两种溶液稀释相同倍数,pH变化较大的是② | |
| C. | 若分别加入25mL0.1mol•L-1盐酸后,pH较大的是① | |
| D. | 若两种溶液的pH均为9,则物质的量浓度大小关系是①>② |
分析 A、NaOH是强碱,电离显碱性;而CH3COONa是强碱弱酸盐,水解显碱性;
B、加水稀释,盐类的水解被促进;
C、若分别加入25mL0.1mol•L-1盐酸后,NaOH被完全反应为NaCl和水;CH3COONa被完全反应为CH3COOH、NaCl和水;
D、盐类的水解程度很小.
解答 解:A、NaOH是强碱,在溶液中完全电离而显碱性;而CH3COONa是强碱弱酸盐,在溶液中水解显碱性,而盐类的水解程度很小,故等浓度的两种溶液中pH①>②,故A错误;
B、加水稀释,氢氧化钠溶液中氢氧根浓度直线下降;而加水稀释,盐类的水解被促进,能水解出更多的氢氧根,故氢氧根的浓度下降比较缓慢,故pH变化较大的是①,故B错误;
C、若分别加入25mL0.1mol•L-1盐酸后,NaOH被完全反应为NaCl和水,溶液显中性;而CH3COONa被完全反应为CH3COOH、NaCl和水,溶液显酸性,故pH较大的是①,故C正确;
D、盐类的水解程度很小,故当两溶液的pH相同时,需要CH3COONa的浓度更大,故D错误.
故选C.
点评 本题考查盐类水解、pH的判断等,明确酸碱混合的计算,盐类水解的规律、pH与浓度的关系等知识即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应放出氢气 | B. | 酸碱中和反应 | ||
| C. | 硫在空气中燃烧 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔 | B. | 丙炔 | C. | 丁炔 | D. | 1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不需要加热就能发生的反应一定是放热反应 | |
| B. | HF、Ca(OH)2、BaSO4都是强电解质 | |
| C. | Na2O2溶于水,生成NaOH,其水溶液能导电,故Na2O2不是电解质 | |
| D. | 升高温度,可同时提高活化分子百分数和活化分子浓度,使化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | 第二次平衡时,Z的浓度为0.2mol•L-1 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 又加入1molZ,平衡没有发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
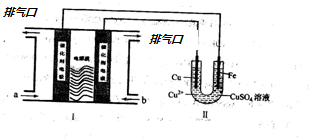
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图中A~K分别代表一种物质.已知A易溶于水,分解得到B、C、D的物质的量比为1:1:2,B气体能使品红溶液褪色,C为常见的液体,D气体能使湿润的紫色石蕊试纸变蓝,F为淡黄色固体单质,K为常见的二元强酸,图中有部分生成物未标出.
图中A~K分别代表一种物质.已知A易溶于水,分解得到B、C、D的物质的量比为1:1:2,B气体能使品红溶液褪色,C为常见的液体,D气体能使湿润的紫色石蕊试纸变蓝,F为淡黄色固体单质,K为常见的二元强酸,图中有部分生成物未标出.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com