
分析 1.0mol•L-1NaHSO3溶液的pH为3.5,说明HSO3-的电离程度大于其水解程度,则[H+]>[OH-],由于氢离子来自水的电离和HSO3-的电离,则[H+]>[SO32-],据此判断溶液中各离子浓度大小.
解答 解:已知1.0mol•L-1NaHSO3溶液的pH为3.5,溶液呈酸性,则[H+]>[OH-],说明HSO3-的电离程度大于其水解程度,由于氢离子来自水的电离和HSO3-的电离,则[H+]>[SO32-],
所以溶液中离子浓度大小为:[Na+]>[HSO3-]>[H+]>[SO32-]>[OH-],
故答案为:[Na+]>[HSO3-]>[H+]>[SO32-]>[OH-].
点评 本题考查了离子浓度大小比较,题目难度不大,明确盐的水解原理及其影响为解答关键,注意掌握判断离子浓度大小的常用方法,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 达到化学平衡时,速率关系为:v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6 | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态 | |
| C. | 达到化学平衡时,若增加体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到化学平衡时v正(O2):v逆(NO)=5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 杂质 | 选用试剂 | 化学方程式 |
| FeCl2溶液 | FeCl3 | 铁粉 | Fe+2FeCl3=3FeCl2 |
| SiO2 | Al 2O3 | 盐酸 | Al2O3+6HCl=2AlCl3+3H2O |
| Fe(OH)3 | Al(OH)3 | NaOH溶液 | Al(OH)3+NaOH=Na[Ai(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl+H2SO4(浓) | B. | Cu+H2SO4(浓) | C. | C+H2SO4(浓) | D. | CuO+H2SO4(浓) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

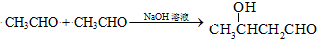 (甘氨酸)
(甘氨酸)
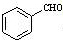 ;
; $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.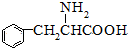 至少需要a步化学反应.
至少需要a步化学反应.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com