
【题目】某有机物A的分子式为C3H7OCl,在一定条件下可以发生如下转化。

完成下列填空。
(1)A中官能团的名称为_____,J是一种六元环状化合物,其结构简式为_____。
(2)在上述反应①—⑨中,属于取代反应的是_____,属于消去反应的是____。
(3)写出下列反应的化学方程式:
B→C_______
C→F________
(4)高分子化合物G的结构简式为_____。
(5)写出I的一种同分异构体(与Na、NaOH溶液和银氨溶液均能反应)的结构简式为_____。
【答案】羟基、氯原子 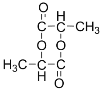 ⑤⑨ ③④
⑤⑨ ③④  +2Cu(OH)2
+2Cu(OH)2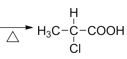 +Cu2O↓+2H2O
+Cu2O↓+2H2O  +2NaOH
+2NaOH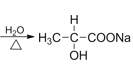 +NaCl+H2O
+NaCl+H2O 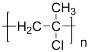
![]()
【解析】
某有机物A的分子式为C3H7OCl,可以连续发生氧化反应,含有伯醇结构,B氧化得到C,C水解反应得到F,而F酸化得到I,则I分子中含有-OH、-COOH,I发生酯化反应得到六元环状化合物J,只能是2分子I发生酯化反应得到环酯,故I分子中-OH、-COOH连接同一碳原子上,则I为![]() ,故J为
,故J为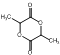 ,转化过程转化碳骨架不变,故A为
,转化过程转化碳骨架不变,故A为![]() ,则B为
,则B为![]() ,C为
,C为![]() ,F为
,F为![]() ;
;
B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为CH2=CHCHO,E与氢气发生加成反应生成H,则H为CH3CH2CH2OH;
有机物A在浓硫酸、加热条件下发生消去反应生成D,则D为CH3C(Cl)=CH2,D在一定条件下生成高聚物G,则G为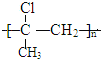 ;
;
(1)A为![]() ,A中官能团的名称为羟基、氯原子,J是一种六元环状化合物,其结构简式为
,A中官能团的名称为羟基、氯原子,J是一种六元环状化合物,其结构简式为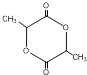 。
。
(2)在上述反应①—⑨中,属于取代反应的是⑤⑨,属于消去反应的是③④。
(3)B为![]() ,C为
,C为![]() ,B→C的反应方程式为:
,B→C的反应方程式为: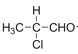 +2Cu(OH)2
+2Cu(OH)2 +Cu2O↓+2H2O ;
+Cu2O↓+2H2O ;
C为![]() ,F为
,F为![]() ,C→F的反应方程式为:
,C→F的反应方程式为:  +2NaOH
+2NaOH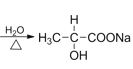 +NaCl+H2O;
+NaCl+H2O;
(4)高分子化合物G的结构简式为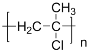 。
。
(5)I为![]() ,I的一种同分异构体能与Na反应、NaOH反应、银氨溶液反应,说明该物质中含有羟基、酯基、醛基,其中一种结构简式为HCOOCH2CH2OH。
,I的一种同分异构体能与Na反应、NaOH反应、银氨溶液反应,说明该物质中含有羟基、酯基、醛基,其中一种结构简式为HCOOCH2CH2OH。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol·L-1·s-1B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.3mol·L-1·s-1D.v(D)=1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
途径③:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①的反应中体现了浓硝酸的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大氧气的浓度来降低成本
C. 由途径①、②、③分别制取1 mol 硫酸,理论上各消耗1 mol 硫,各转移6 mol 电子
D. 途径②、③比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素。
下列判断错误的是
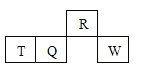
A. 原子半径:T > Q
B. 元素非金属性:Q > R
C. 气态氢化物的热稳定性:R>Q
D. 最高价氧化物对应水化物的酸性: W > Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种常用的化工原料,经常可以用来转化成高附加值的CO、CH4、CH3OH、CO(NH2)2等一碳(C1)产物。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示。该反应的ΔH___(填“>”、“<”或“=”,下同)0,若y表示压强,则y1___y2,若y表示反应开始时的氨碳比[
CO(NH2)2(s)+H2O(g)。在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示。该反应的ΔH___(填“>”、“<”或“=”,下同)0,若y表示压强,则y1___y2,若y表示反应开始时的氨碳比[![]() ],则y1__y2。
],则y1__y2。

Ⅱ.CO2加氢过程,主要发生的三个竞争反应为:
反应i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H=-49.01kJmol-1
CH3OH(g)+H2O(g) H=-49.01kJmol-1
反应ii:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) H=-165.0kJmol-1
CH4(g)+2H2O(g) H=-165.0kJmol-1
反应iii:CO2(g)+H2(g)![]() CO(g)+H2O(g) H=+41.17kJmol-1
CO(g)+H2O(g) H=+41.17kJmol-1
回答下列问题:(1)由CO、H2合成甲醇的热化学方程式为__。
(2)如图是某甲醇燃料电池工作的示意图。

质子交换膜(只有质子能够通过)左右两侧的溶液均为1L2mol·L-1H2SO4溶液。电极a上发生的电极反应为___,当电池中有1mole发生转移时左右两侧溶液的质量之差为___g(假设反应物耗尽,忽略气体的溶解)。
(3)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按![]() =3∶1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
=3∶1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
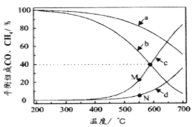
则表示1MPa时CH4和CO平衡组成随温度变化关系的曲线分别是___、___。M点所表示物质的平衡组成高于N点的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是

A. t1℃时,A的饱和溶液65 g中含有溶剂50 g
B. 将t1℃ A、B、C三种物质的饱和溶液升温至t2℃ 时,溶液中溶质的质量分数是A=B>C
C. A中含少量C时可用降温结晶法提纯A
D. 25%的A溶液降温至t1℃时会有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用王水(浓硝酸和浓盐酸按体积比1:3的混合物)来溶解白金等贵金属进行科学实验。王教授用质量分数为63%的浓硝酸(密度1.40g/ ![]() )和质量分数为36.5%的浓盐酸(密度1.19g/
)和质量分数为36.5%的浓盐酸(密度1.19g/ ![]() )来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
)来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
A. 该王水中硝酸的物质的量浓度是3.5mol/L
B. 该王水中氧元素的质量是100.8g
C. 该王水的密度约为1.24g/ ![]()
D. 该王水中HCl的质量分数约为26.2%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铁屑(主要成分为Fe,还含有C,S,P等)制取高效净水剂K2FeO4流程如图:

下列说法不正确的是
A. 废铁屑在酸溶前可用热的纯碱溶液去油污
B. 步骤②是将Fe2+转化为Fe(OH)3
C. 步骤③中发生的反应的离子方程式为2Fe(OH)3+3ClO-==2FeO42-+3Cl-+4H++H2O
D. 步骤④中反应能发生的原因是在相同条件下,K2FeO4的溶解度小于Na2FeO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com