
(14分)碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。

A.H2的逆反应速率
B.CH4的的体积分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
(4)若往20mL 0.0lmol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是

①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO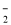 )>c(OH
)>c(OH )> c(H+)
)> c(H+)
(1) ①-1160kJ/mol(2分)
(2) ①0.012mol?L-1?min-1(2分) ②B、D(2分);③<(2分) B、C(2分)
(3) N2+6H+ +6e- = 2NH3(2分) (4) ② ③(2分)
【解析】
试题分析:(1)将两式相加可得:2CH4(g) + 4NO2(g) =2N2(g)+2CO2(g) + 4H2O(g) ΔH1=-(574+x) kJ/mol=—1734 kJ/mol,解得x=—1160kJ/mol,所以ΔH2=—1160kJ/mol;(2)n(Fe2O3)=3.2g÷160g/mol=0.02mol,则n(CO)=3 n(Fe2O3)=0.06mol,则该段时间内CO的平均反应速率为V(CO)= 0.06mol÷5L÷1min=0.012mol?L-1?min-1;②由于该反应是反应前后气体体积相等,正反应是吸热反应,A.CH4的系数与CO的系数相等,所以在任何情况下CH4转化率等于CO的产率,因此不能判断反应达到平衡状态,错误;B.若反应未达到平衡状态,则气体的质量发生改变,气体的平均相对分子质量就会改变,因此若混合气体的平均相对分子质量不变,则反应处于平衡状态,正确;C.由于H2、CO都是生成物,在任何情况下,v(CO)与v(H2)的比值不变,因此不能作为判断平衡的标志,错误;D.若反应未达到平衡状态,就会有O元素进入气体或从气体中变为固体,使固体的总质量发生变化,因此若固体质量不变,则反应处于平衡状态,正确;③由于该反应的正反应是吸热反应,升高温度,根据平衡移动原理:平衡向吸热反应方向移动,对该反应来说就是 温度,平衡正向移动,所以化学平衡常数增大,所以KA<KB。A.升高温度,无论是放热反应还是吸热反应,反应速率都加快,所以H2的逆反应速率增大,与图像不吻合,错误;B.升高温度,平衡正向移动,CH4的的体积分数减小,与图像吻合,正确;C.升高温度,平衡正向移动,气体的质量增加,而气体的物质的量增大,气体物质的量增大的大于气体质量增加的,所以混合气体的平均相对分子质量减小,与图像吻合,正确;D.升高温度,平衡正向移动,CO的体积分数增大,与图像不吻合,错误;(3)电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为N2+6H+ +6e- = 2NH3;(4)酸碱中和反应是放热反应,而二者恰好完全反应时溶液的温度最高。由于温度最高时,NaOH溶液的体积是20ml,HNO2+NaOH=NaNO2+ H2O。n(NaOH)=n(HNO2)= 0.02L×0.0lmol/L=2×10-4mol,所以c(NaOH)= 2×10-4mol÷0.02L=0.01mol/L;所以①错误;②正确;③由于在b点时温度高于a点,弱电解质HNO2的电离是吸热过程,升高温度,促进该酸的电离,所以电离平衡常数:b点>a点,正确;④从b点到c点,在b点时是NaNO2溶液,当到c点时,是NaNO2和NaOH等浓度、等体积的混合溶液,NaNO2是强碱弱酸盐,NO2-水解消耗水电离产生的H+,最终当溶液达到平衡时,c(OH-)> c(H+),根据物料守恒可得:c(Na+)>c(NO2-),但是盐水解的程度是微弱的,盐电离产生的离子远大于水电离产生的离子浓度。所以混合溶液中一直存在:c(Na+)> c(NO2-)> c(OH-)> c(H+),当在c点由于增加NaOH,二者是等物质的量混合,所以c(Na+))>c(OH-)> c(NO2-)> c(H+),错误。故选项是B、C;
2NH3,该过程中还原反应的方程式为N2+6H+ +6e- = 2NH3;(4)酸碱中和反应是放热反应,而二者恰好完全反应时溶液的温度最高。由于温度最高时,NaOH溶液的体积是20ml,HNO2+NaOH=NaNO2+ H2O。n(NaOH)=n(HNO2)= 0.02L×0.0lmol/L=2×10-4mol,所以c(NaOH)= 2×10-4mol÷0.02L=0.01mol/L;所以①错误;②正确;③由于在b点时温度高于a点,弱电解质HNO2的电离是吸热过程,升高温度,促进该酸的电离,所以电离平衡常数:b点>a点,正确;④从b点到c点,在b点时是NaNO2溶液,当到c点时,是NaNO2和NaOH等浓度、等体积的混合溶液,NaNO2是强碱弱酸盐,NO2-水解消耗水电离产生的H+,最终当溶液达到平衡时,c(OH-)> c(H+),根据物料守恒可得:c(Na+)>c(NO2-),但是盐水解的程度是微弱的,盐电离产生的离子远大于水电离产生的离子浓度。所以混合溶液中一直存在:c(Na+)> c(NO2-)> c(OH-)> c(H+),当在c点由于增加NaOH,二者是等物质的量混合,所以c(Na+))>c(OH-)> c(NO2-)> c(H+),错误。故选项是B、C;
考点:考查 盖斯定律的应用、化学反应速率的计算、化学平衡状态的判断、原电池反应中电极反应式的书写、酸碱混合溶液中物质浓度的计算及离子浓度大小比较的知识。


科目:高中化学 来源:2014-2015学年湖南省益阳市高一12月月考化学试卷(解析版) 题型:填空题
(10分)已知砒霜As2O3与Zn可以发生如下反应:
As2O3+6Zn+6H2SO4===2AsH3↑+6ZnSO4+3H2O
(1)请用双线桥法标出电子转移的方向和数目。_____________________________。
(2)As2O3在上述反应中显示出来的性质是____________________。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为_____________________。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二上学期期中化学试卷(解析版) 题型:选择题
下列各原子或离子的电子排列式错误的是
A.Na+ 1s22s22p6 B.F? 1s22s22p6
C.N3+ 1s22s22p6 D.O2? 1s22s22p6
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次质量检测化学试卷(解析版) 题型:选择题
Ksp(AgCl)=1.56×10-10 ,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12 ,已知,某溶液中含有C1-, Br- 和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.C1- 、Br-、CrO42- B.CrO42-、Br-、C1-
C.Br-、C1-、CrO42- D.Br- 、CrO42-、C1-
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次质量检测化学试卷(解析版) 题型:选择题
下列溶液一定是碱性的是
A.pH=8的某电解质的溶液 B.c(OH-)>1×10-7mol/L
C.溶液中含有OH- D.溶液中c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考理综化学试卷(解析版) 题型:选择题
一定条件下存在反应:H2(g) + I2(g) 2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深
D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邢台市高三上学期第四次月考化学试卷(解析版) 题型:填空题
(12分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。

(3)判断反应③△H 0; △S 0(填“>”“=”或“<”)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆) (填“>”“=”或“<”)
(4)甲醇燃料电池通常采用铂电极,其工作原理如图所示,负极的电极反应为: 。

(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的醋酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邢台市高三上学期第四次月考化学试卷(解析版) 题型:选择题
苹果酸的结构简式为 ,下列说法正确的是
,下列说法正确的是
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量金属Na反应生成1 mol H2
D.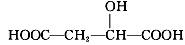 与苹果酸互为同分异构体
与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高三上学期期中考试化学试卷(解析版) 题型:选择题
反应A(s)+2B(g) 2C(g)在一密闭容器中进行,当改变下列条件之一时,一定能增大反应速率的是
2C(g)在一密闭容器中进行,当改变下列条件之一时,一定能增大反应速率的是
A.增加A物质的质量 B.降低温度
C.压缩反应容器体积 D.消耗掉部分B物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com