
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,Y的转化率为75% |
| B、该反应可表示为X+3Y?2Z,且常温下的平衡常数为1600 |
| C、其它条件不变时,增大压强能使上述平衡向生成Z的方向移动,且平衡常数将增大 |
| D、若升高温度能使该反应的平衡常数减小,说明该反应的正反应为放热反应 |
| 0.15mol/L |
| 0.2mol/L |
| c2(Z) |
| c(X)c3(Y) |
| 0.12 |
| 0.05×0.053 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氢铝化合物与水反应生成氢氧化铝和氢气 |
| B、与H2O反应生成2.24 L H2(标况下),转移的电子为0.2 mol |
| C、氢铝化合物中氢显-1价 |
| D、氢铝化合物具有强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
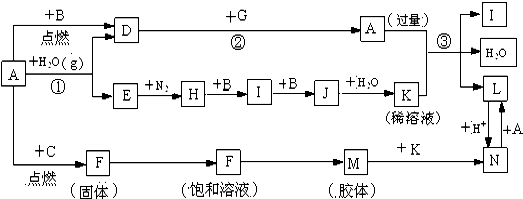
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单体的结构式为CH2=CH-COOR |
| B、在一定条件下能发生加成反应 |
| C、在一定条件下能发生水解反应 |
| D、没有固定熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何分子内一定存在化学键 |
| B、分子中若有化学键,则一定存在σ键 |
| C、p和p轨道不能形成σ键 |
| D、含π键的物质一定不如含σ键的物质稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO+H2O═Ca(OH)2 |
| B、SO2+2NaOH═Na2SO3+H2O |
| C、CaCO3+2HCl═CaCl2+H2O+CO2↑ |
| D、Cl2+2KI═2KCl+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、=9.2 | B、<9.2 |
| C、>9.2 | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 仔细观察如图两种电池的构造示意图,完成下列问题:
仔细观察如图两种电池的构造示意图,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L甲醇中含有的分子数为0.1NA |
| B、1L 0.1mol/L Na2CO3溶液中,含有的CO32-数目为0.1NA |
| C、室温下,1.40g乙烯和丁烯的混合气体中含有的碳原子数目为0.1NA |
| D、标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com