
【题目】一定温度时,1L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196kJ/mol,数据:
2SO3(g) △H=-196kJ/mol,数据:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1 min1
B. 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.1molO2时,v (正)> v (逆)
C. 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
【答案】AD
【解析】根据表格数据,完成表格其余空格,
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | 0.6 |
10 | 0.8 | 0.4 |
15 | 0.8 | 0.4 |
A、根据化学反应速率的数学表达式,前5min的平均速率v(SO2)=(2-1.2)/(5×1)mol/(L·min)=0.16 mol/(L·min),故A说法错误;B、此温度下的化学平衡常数,K= 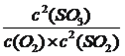 ,达到平衡时c(SO3)=1.2mol·L-1,c(SO2)=0.8mol·L-1,c(O2)=0.4mol·L-1,代数数值,求的K=5.625,达到平衡后再充入0.2molSO2和0.1molO2,此时浓度商Qc=2.88<K,说明此反应向正反应方向进行,即v(正)>v(逆),故B说法正确;C、其他条件保持不变,起始时充入2molSO3,建立平衡后,与原平衡为等效平衡,即SO3的转化率为40%,则达到平衡吸收的热量为196×2×40%/2kJ=78.4kJ,故C说法正确;D、如果为恒压条件,充入1.5molSO3,与原平衡为等效平衡,SO3的转化率为40%,如果为恒容状态,则不与原平衡为等效平衡,SO3的转化率不等于40%,应小于40%,故D错误。
,达到平衡时c(SO3)=1.2mol·L-1,c(SO2)=0.8mol·L-1,c(O2)=0.4mol·L-1,代数数值,求的K=5.625,达到平衡后再充入0.2molSO2和0.1molO2,此时浓度商Qc=2.88<K,说明此反应向正反应方向进行,即v(正)>v(逆),故B说法正确;C、其他条件保持不变,起始时充入2molSO3,建立平衡后,与原平衡为等效平衡,即SO3的转化率为40%,则达到平衡吸收的热量为196×2×40%/2kJ=78.4kJ,故C说法正确;D、如果为恒压条件,充入1.5molSO3,与原平衡为等效平衡,SO3的转化率为40%,如果为恒容状态,则不与原平衡为等效平衡,SO3的转化率不等于40%,应小于40%,故D错误。


科目:高中化学 来源: 题型:
【题目】有0.1 mol/L的盐酸(a)、硫酸溶液(b)、醋酸溶液(c)各50 mL,试比较:
(1)三种酸的氢离子浓度由大到小的顺序是_________;三种酸的pH由大到小的顺序是______(填字母代号,下同)。
(2)三种酸跟足量的锌反应,开始时产生H2的速率由大到小的顺序是____________(不考虑Zn的纯度及表面积等问题)。
(3)三种酸跟足量的锌反应产生H2的体积由大到小的顺序是__________________。
(4)三种酸分别跟0.1 mol/L的NaOH溶液中和,消耗NaOH溶液的体积由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属通性的叙述不正确的是( )
A. 在反应中金属原子易失去最外层上的电子
B. 金属单质只具有还原性,而不具有氧化性
C. 金属元素在化合物中不可能为负价
D. 金属单质都能与盐酸溶液发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途说法不正确的是
A. 液氨常用作制冷剂 B. 磁性氧化铁可用作红色油漆和涂料
C. 硫酸常用于金属加工前的酸洗 D. 氧化铝可用于制造耐高温实验材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,装置Ⅰ为甲醇燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
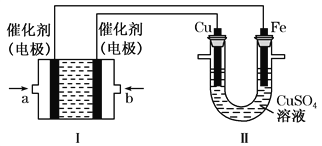
(1)b处应通入_____(填“CH3OH”或“O2”),a处电极上发生的电极反应式是___________________;
(2)电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______________;
(3)若铜电极质量减小6.4 g,则消耗标况下的O2的体积为_____________________。
(4)若将装置I中电解质溶液换成硫酸溶液,则在工作过程中H+ 移向______电极(填“a”或“b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业上利用反应ZnFe2 (C2O4)3·6H2O![]() ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。
(1)ZnFe2O4中Fe的化合价为___________。
(2)该反应中还原产物是________(填化学式),每生成1mol ZnFe2O4,转移的电子数为________。
Ⅱ.在pH=l的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:
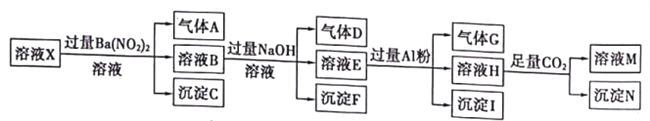
已知:NO3-+Al+OH-+H2O→NH4++[Al(OH)4]-
(1)溶液X中除H+外,一定存在的离子是_________________。
(2)写出生成沉淀N的离子方程式_________________。
(3)若取原溶液X少许直接加入AgNO3溶液产生白色沉淀,则确定该溶液中一定含有Cl-,你认为这种说法是否合理。_______(填“是”或“否”),其理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.Na2CO3水解的离子方程式为:CO32- + 2H2O![]() H2CO3 + 2OH-
H2CO3 + 2OH-
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224.00L氯化氢气体溶于635.00mL的水(密度为1.00g/cm3)中,所得盐酸的密度为1.18g/cm3 . (要求有解题过程)
(1)该盐酸的质量分数是多少?
(2)取这种盐酸100.00mL,稀释到500.00mL,所得的稀盐酸的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是硫酸
B. 反应①过滤后所得沉淀1为氧化铁
C. 图中所示转化中:Al2O3→Al可选用热分解法
D. 反应②的离子方程式为2AlO2 - + CO2 + 3H2O = 2Al(OH)3↓+ CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com