
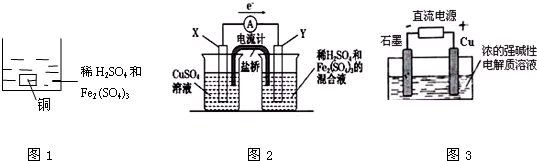
| A����ͼ1��ʾ��һ������ͭƬ���뵽100 mLϡ������������Ļ����Һ�У���ͭƬ��ȫ�ܽ�ʱ���������ε�ˮ�⼰��Һ����ı仯������Һ�е�Fe3+��Cu2+��H+�������ӵ����ʵ���Ũ����ȣ��Ҳ����Һ��pH=1������Һ��c��SO42-��Ϊ0.5mol/L |
| B����ͼ2��ʾ��װ���з���Cu+2Fe3+�TCu2++2Fe2+�ķ�Ӧ��X���Ǹ�����Y���IJ��Ͽ�����ͭ |
| C��Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ���ʾ��ͼ��ͼ3��ʾ��ʯī�缫�ϲ���������ͭ�缫������ԭ��Ӧ |
| D����ͼ3��ʾ������0.1mol����ת��ʱ����0.1mol Cu2O���� |


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ֻ�Т٢� |
| B��ֻ�Т٢ۢ� |
| C��ֻ�Т٢ۢܢ� |
| D���٢ڢۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
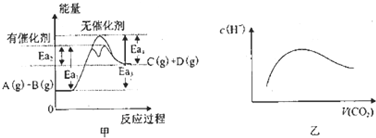
| A���ɼ�֪��A��B���д������ڵ��Ȼ�ѧ����ʽΪ��A��g��+B��g��?C��g��+D��g����H�T+��Ea3-Ea4��KJ?mol-1 | ||||
B�����³�ѹ�£���a mol CO2����ͨ��1L bmol/L��NaOH��Һ�У���a=2bʱ������CO2�����ͨ�룬��Һ����ˮ�������c��H+������ͼ�ұ仯��ϵ����
| ||||
| C����֪CaCO3��Ksp=2.8��10-9���ֽ��������Na2CO3��Һ��CaBr2��Һ��ϣ���CaBr2��Һ��Ũ��Ϊ5.6��10-5mol/L�������ɳ�������Na2CO3��Һ����СŨ��Ϊ2��10-4mol/L | ||||
| D��ij�¶��£�pH=11��NH3?H2O��pH=1������������̨�����ǻ�̨����Һ����ı仯��ǡ����ȫ��Ӧ����Ӧ�����Ҵ��NH4+��NH3?H2O��NH3��������ƽ��Ũ��֮��Ϊ0.05mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʯ���ѽ�õ������Ϳ���������ˮ�н�ȡ�����ȡ�� |
| B�������ø���ķ�����ú�еı��ͱ��ӵȷ��� |
| C��ʯ�ͷ����Ʒ���ڴ��������£�ͨ���ѻ���Ӧ���Ӷ�������͵IJ��������� |
| D��ˮú����ͨ��ú��Һ���õ�������ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2240mL |
| B��4480mL |
| C��3360mL |
| D��1120mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ȶ��ԣ�H2O��H2S��H2Se |
| B���뾶��Na+��Mg2+��F- |
| C�����ԣ�HClO4��H2SO4��H3PO4 |
| D�����ԣ�NaOH��Mg��OH��2��Al��OH��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������оƬ�����Ԫ��λ�ڵ�14�� |
| B��Ԫ�����ڱ�����7�����ڣ�16���� |
| C��ÿһ���ڵ�Ԫ�ض��ǴӼ������ʼ�������ϡ��������� |
| D���ڶ����������У�ͬһ����������Ԫ�ص�ԭ�Ӻ�����������8�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��x+y��z |
| B��ƽ�����淴Ӧ�����ƶ� |
| C��B��ת���ʽ��� |
| D��C����������½� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
| ʵ����� | ��Ӧ�¶�/�� | H2C2O4��Һ | ����KMnO4��Һ | H2O | ||
| V/mL | c/��mol?L-1�� | V/mL | c/��mol?L-1�� | V/mL | ||
| �� | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| �� | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com