

分析 (1)常温常压是指25℃,101KPa;
(2)加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积,可得生成氢气的体积为,根据Mg的质量计算生成氢气物质的量,进而计算气体摩尔体积;
相对误差是指测量所造成的绝对误差与真值之比,再乘以100%所得的数值;
反应放热,气体体积热胀冷缩,Mg中含有Al时,生成氢气体积偏大,导致测定值偏大,没有除去镁带表面的氧化物、所用硫酸的量不足,导致生成氢气体积偏小,导致测定值偏小;
(3)利用液封气体,形成量气管内与水准管内液面存高度差,一定时间内液面差不变,说明气密性良好;
(4)与图1相比,该装置能更简便、更准确地控制气压不变;量气管由滴定管改制,读数更精确等.
解答 解:(1)常温常压下的压强为101KPa,温度为25℃,
故答案为:101KPa;25℃;
(2)生成氢气的体积为115mL-10mL+8mL=113mL,0.108gMg完全反应得到氢气为$\frac{0.108g}{24g/mol}$=0.0045mol,可得气体摩尔体积为$\frac{0.113L}{0.0045mol}$=25.1mol/L,相对误差为$\frac{25.1mol/L-24.5mol/L}{24.5mol/L}$×100%=+2.5%,
反应放热,气体体积热胀冷缩,Mg中含有Al时,生成氢气体积偏大,导致测定值偏大,没有除去镁带表面的氧化物、所用硫酸的量不足,导致生成氢气体积偏小,导致测定值偏小,故选ac,
故答案为:25.1L;+2.5;ac;
(3)该装置气密性的检查方法是:从水准管中加入水,快速上移或下移水准管,若量气管内液面最终与水准管液面存在稳定的液面差即气密性良好,
故答案为:从水准管中加入水,快速上移或下移水准管,若量气管内液面最终与水准管液面存在稳定的液面差即气密性良好;
(4)与图1相比,该装置能更简便、更准确地控制气压不变,借助水浴装置,实验温度更接近常温(水浴能减小反应放热带来的误差),量气管由滴定管改制,读数更精确,
故答案为:该装置能更简便、更准确地控制气压不变;量气管由滴定管改制,读数更精确等.
点评 本题考查定量测定实验,涉及气体摩尔体积的测定,关键是理解测定原理计算生成氢气的体积,较好的考查学生分析计算能力.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
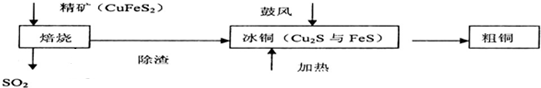
| A. | 焙烧时硫元素全部转化为二氧化硫 | B. | 在焙烧时氧化剂只有氧气 | ||
| C. | 粗铜精炼时用粗铜做阴极 | D. | Cu2S可用于火法炼制铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各元素的最高正化合价跟族的序数相等 | |
| B. | 所有元素都有正化合价和负化合价,它们的绝对值之和等于8 | |
| C. | 非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数 | |
| D. | 各元素原子的最外层电子数跟族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa) | |
| B. | 浓度均为0.2mol/L NaHCO3和 Na2CO3溶液中,存在的粒子种类不相同 | |
| C. | 0.4 mol•L-1HCN 溶液与 0.2 mol•L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+) | |
| D. | 25℃时,pH=4且浓度均为0.1 mol•L-1的 CH3COOH、CH3COONa混合溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com