
【题目】反应KIO3+6KI=3I2+KI+3 H2O,氧化剂与还原剂的物质的量之比为( )
A.1:1B.1:6C.1:5D.5:1
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱如图。关于A的下列说法中,不正确的是
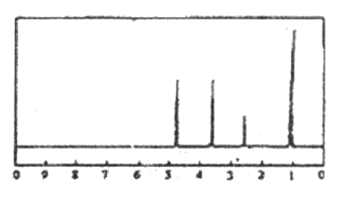
A. A分子属于酯类化合物
B. A在一定条件下可与H2发生加成反应
C. 符合题中A分子结构特征的有机物不只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
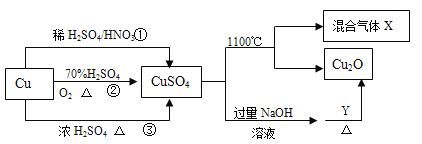
A. Y可以是葡萄糖
B. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
C. 相对于途径①、③,途径②更好地体现了绿色化学思想
D. 1 mol CuSO4在1100 ℃所得混合气体X中O2为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 纯铁为灰黑色,所以铁属于黑色金属
B. 铁在硫蒸气中燃烧生成Fe2S3
C. 纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化
D. 足量的铁在氯气中燃烧生成FeCl2和FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:

查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如下图是所示。
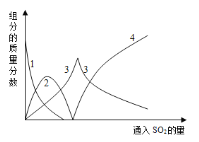
(1)如图中的线2表示的组分为____________(填化学式)
(2)写出如图曲线4的反应方程式:__________________________
(3)实验时,“反应Ⅱ”中加入NaOH溶液的目的是_______________________(用化学方程式表示)
(4)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了下列方法进行测定。
称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过滤、洗涤、干燥后称重,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
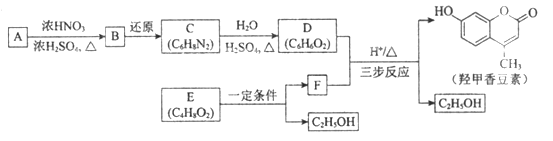
己知:
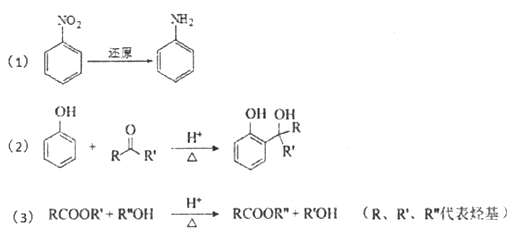
请回答下列问题:
(1)A属于芳香烃,其结构简式是____________;B中所含的官能团是____________。
(2)C→D的反应类型是____________。
(3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式____________。
(4)己知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和____________。
和____________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:________
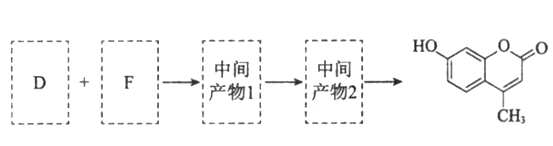
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应放出______________kJ 的热量。
(2)天然气既是高效洁净的能源,也是重要的化工原料。
①甲烷分子的结构式为_________,空间构型为_______________。
②甲烷高温分解生成氢气和炭黑。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是__________________________________________。
(3)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________(填序号)。

(4)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)某短周期元素组成的分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结
构,原子间以单键相连。下列有关说法中错误的是(________)
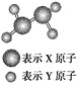
A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为N2F4
(2)若上述模型中Y原子最外层达到2电子稳定结构且其相对分子质量与O2相同,则该物质的分子式为______________,它与P2H4常温下均为气体,但比P2H4易液化,常用作火箭燃料,其主要原因是______________________________________________________________________。
Ⅱ.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)X、Z两种元素的元素符号:X___________________________________________、
Z______________________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________;含有极性共价键和非极性共价键的化合物的电子式为________________________________。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________________________________________________________________________________________;
X与W形成的化合物与水反应时,水是_____________________________________
(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z的过程: __________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com