
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与硝酸在一定条件下反应生成硝基苯;乙烯与溴的四氯化碳溶液反应 | |
| C. | 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,水层褪色;乙烯与溴水反应 |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,根据定义分析解答.
解答 解:A、甲烷和氯气混合光照一段时间后,甲烷中的氢原子被氯原子所代替生成氯代物,所以属于取代反应;乙烯使酸性高锰酸钾溶液褪色,是高锰酸钾和乙烯发生了氧化反应的结果,故A错误;
B、在浓硫酸和加热条件下,苯环上的氢原子被硝基取代生成硝基苯,所以属于取代反应;乙烯使溴的四氯化碳溶液褪色,是乙烯中的双键断裂,两个碳原子上分别结合两个溴原子,该反应属于加成反应,故B正确;
C、在一定条件下,乙烯中的双键断裂,一个碳原子上结合一个氢原子,另一个碳原子上结合羟基,生成乙醇,该反应属于加成反应,故C错误;
D、苯能萃取溴水中的溴而使水层无色,不是加成反应是萃取;乙烯使溴水褪色,是乙烯中的双键断裂,两个碳原子上分别结合两个溴原子,该反应属于加成反应,故D错误.
故选B.
点评 本题考查了取代反应和加成反应的判断,难度不大,明确这两个概念的区别是解本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第IVA族 | |
| C. | 与氢气化合时,Z比Y容易 | |
| D. | 甲中只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
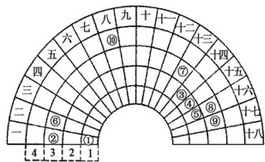 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题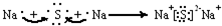
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
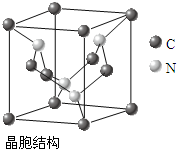
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ①②⑤ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
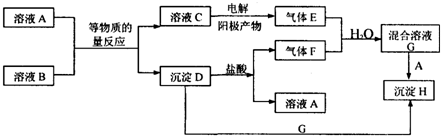
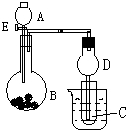 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com