
【题目】已知:2Cu(IO3)2+24KI+12H2SO4=2CuI![]() (碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
(碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
A.Cu(IO3)2作氧化剂,Cu(IO3)2中只有碘元素被还原
B.CuI既是氧化产物又是还原产物
C.每生成1mol CuI,有11mol KI发生氧化反应
D.每转移1.1mol电子,有0.2mol IO3-被氧化
科目:高中化学 来源: 题型:
【题目】用图表来处理数据是发现科学规律的一种重要方法。
(1)下图是原子序数为1~18的元素原子的最外层电子数随原子序数变化的直方图。图中元素a 是__,b 是____。

(2)下图表示元素的一种性质随原子序数变化的情况,根据分析,该图纵坐标表示的是_________。

(3)下表给出了部分元素的原子半径。
元素符号 | Li | Be | B | C | N | O | F | Na | K | Rb | Cs |
原子半径/nm | 0.152 | 0.089 | 0.082 | 0.077 | 0.075 | 0.074 | 0.071 | 0.186 | 0.227 | 0.248 | 0.265 |
请根据表中数据分析同周期元素原子半径的递变规律是______,同主族元素原子半径的递变规律是_____根据表中得出的规律比较Ca2+和Cl-的半径大小:r(Ca2+)_____r(Cl-)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生兴趣小组模拟工业制取无水Na2SO3的过程如下:

已知:①反应Ⅰ在三颈烧瓶中发生,装置如图所示(固定及加热类仪器省略);
②H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图;
③Na2SO3·7H2O 和Na2SO3的溶解度曲线如图。
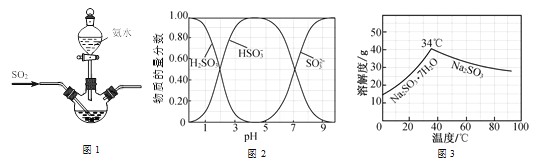
(1)为提高Na2SO3产率,反应Ⅰ应控制pH在_____左右。
(2)反应Ⅱ所得滤液的主要成分是_____和Na2SO3。
(3)将操作Ⅰ后所得的Na2SO3溶液_____(填操作),过滤出的固体用无水乙醇洗涤、在真空干燥箱中采用150℃干燥,得无水Na2SO3固体。
(4)可以用KIO3测定产品中无水Na2SO3的纯度:称取0.1260 g样品于锥形瓶中,用蒸馏水溶解,并加入淀粉做指示剂,滴加酸性KIO3溶液(a mol·L-1)至Na2SO3恰好完全氧化成Na2SO4,发生反应3Na2SO3 + KIO3 = 3Na2SO4 + KI,消耗KIO3溶液体积为b mL。通过计算确定样品中Na2SO3的质量分数(写出计算过程)____
(5)滴加酸性KIO3溶液时,剧烈震荡锥形瓶或者滴加时间过长都会造成所测Na2SO3纯度偏低,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦成功提取到一种分子式为C15H22O5的无色结晶体,命名为青蒿素,这是一种可用于治疗疟疾的固态有机药物,在水溶液中不电离,关于青蒿素的说法正确的是( )
A.5.64g青蒿素含氧原子数目为0.02NA
B.标准状况下2mol青蒿素的体积为44.8L
C.青蒿素属于非电解质
D.青蒿素的摩尔质量为282
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2![]() +8H2O,下列说法正确的是 ( )
+8H2O,下列说法正确的是 ( )
A.氧化产物与还原产物的物质的量之比为2:5
B.每生成1molCl2时转移2mol e-
C.KMnO4的还原性强于Cl2的还原性
D.参与反应的氧化剂与还原剂的物质的量之比为1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。

(1)调整天平零点时,若指针偏向右边,应将左边的螺丝____________(填“向左”或“向右”)旋动。
(2)滴加NaOH溶液,生成沉淀的离子方程式为_______________________________。
(3)加热蒸发过程中要用到玻璃棒,其作用是_________________________________。
(4)洗涤该沉淀的方法是______________________________________________________,为了检验此沉淀是否洗涤干净,应取最后一次的洗涤液少许,加入__________溶液检验。
(5)若向CuSO4溶液中滴加了100mLNaOH溶液,则NaOH溶液的物质的量浓度至少为_________。
(6)理论上最多可以制得CuO的质量为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com