
��A��B��ƽ��ʱ��Ũ��֮��Ϊ5��3 ��x=2 ��B��ƽ��Ũ��Ϊ1.5 mol��L-1 ��A��ת����Ϊ20%
A.ֻ�Т� B.ֻ�Т٢�
C.ֻ�Тڢۢ� D.ֻ�Тۢ�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| B | C | D | ||
| A | E |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����������Ԫ��A��B��C��D��E��Ԫ�����ڱ��е�λ������ͼ��ʾ����ش��������⣺
����������Ԫ��A��B��C��D��E��Ԫ�����ڱ��е�λ������ͼ��ʾ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������Ԫ��A��B��C��D��E��Ԫ�����ڱ��е�λ������ͼ��ʾ��
��ش��������⣺
��1��B��C��DԪ�ص縺�ԵĴ�С˳��Ϊ��______��______��______(��Ԫ�ط���)��
��2��E���⻯����������������ˮ����ļ��ι����ܷ�����Ӧ������һ�����嵥�ʣ���Ӧ�Ļ�ѧ����ʽΪ_______________________________________________.
��3��C�ж�����������м���Է���������С����һ�������£�2L��������0.5L�������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û����������������ɵĺ������εĻ�ѧʽ��__________.
��4����298K�£�A��B�ĵ��ʸ�1mol��ȫȼ�գ��ֱ�ų�����a kJ��b kJ����֪һ�������£�A�ĵ����ܽ�B������������������û������������û���Ӧ����3molB�ĵ��ʣ���÷�Ӧ��298K�µ�![]() = (ע���������赥�ʾ�Ϊ���ȶ�����)
= (ע���������赥�ʾ�Ϊ���ȶ�����)
��5��Ҫ֤����Dͬ��������Ԫ��F�ķǽ�������E�ķǽ����Ե�ǿ������ȷ��������ʵ�������������
��6����A��B�ĵ������缫��C������������ˮ����ϡ��Һ���������Һ����ԭ��أ�д����ԭ��������ĵ缫��Ӧʽ ��������Cֻ����ԭ��+2�ۣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʡ�����ظ���ѧ���������ο��Ի�ѧ�Ծ����������� ���ͣ������
��9�֣�����������Ԫ��A��B��C��D��E��Ԫ�����ڱ��е�λ����ͼ��ʾ����ش��������⣺
| | B | C | D | |
| A | | | | E |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ����У�Ϻ��У�����������ѧ�Ծ��������棩 ���ͣ������
�����8�֣�
ˮú�����Ƽ״��������̿�ͼ����
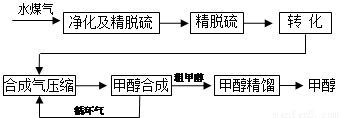
(ע:��ȥˮ�������ˮú����55��59%��H2��15��18%��CO��11��13%��CO2��������H2S��CH4����ȥH2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ���������ɽ��м״��ϳ�)
��1����ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C��s��+H2O��g�� CO��g��+H2��g�����˷�Ӧ�����ȷ�Ӧ���� �˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ
��
CO��g��+H2��g�����˷�Ӧ�����ȷ�Ӧ���� �˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ
��
�����������̼��ƽ��ת���ʵĴ�ʩ�� ��
A������C��s�� B������H2O��g�� C�������¶� D������ѹǿ
��2����CH4ת����CO����ҵ�ϳ����ô�ת���������䷴Ӧԭ��Ϊ��
CH4
(g)+3/2O2 (g) CO (g)+2H2O (g) +519KJ����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
CO (g)+2H2O (g) +519KJ����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
�� X��T1��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
�� Y��T2��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
�� Z��T3��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
��֪��T1��T2��T3������������Ϣ������Ϊ��������Ӧ��ѡ������˴����� ���X����Y����Z������ѡ��������� ��
��3���ϳ�����ѹ�����º����10m3�״��ϳ������ڴ��������£����м״��ϳɣ���Ҫ��Ӧ�ǣ�2H2(g) + CO(g)  CH3OH(g)+181.6kJ��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OH(g)+181.6kJ��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
|
���� |
H2 |
CO |
CH3OH |
|
Ũ��/��mol��L��1�� |
0.2 |
0.1 |
0.4 |
�� �Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v�� v�� ���>������<������)��
�� ������ͬ�����CO��H2����T5�淴Ӧ��10 min��ﵽƽ�⣬��ʱc(H2)��0.4 mol��L��1��c(CO)��0.7 mol��L��1�����ʱ���ڷ�Ӧ����v(CH3OH) �� mol��(L��min)��1��
��4�����������У��ϳ���Ҫ����ѭ������Ŀ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com