
| A. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| B. | 将8.0gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为0.2mol/L | |
| C. | 阿伏加德罗常数个H2O分子在标准状况下的体积是22.4L | |
| D. | 在标准状况下,20mLNH3与60mLO2所含的分子个数比为1:3 |
分析 A.氧气不一定处于标况下,22.4LO2的物质的量不一定为1mol;
B.8.0g NaOH为0.2mol,溶于水配成1L溶液,所得溶液浓度为0.2mol/L;
C.阿伏加德罗常数个H2O分子的物质的量为1mol,标况下水不是气体;
D.同温同压下,气体分子数目之比等于气体的体积之比.
解答 解:A.体积一定时,温度、压强会影响气体摩尔体积,氧气不一定处于标况下,22.4LO2的物质的量不一定为1mol,即含有氧气分子不一定为6.02×1023个,故A错误;
B.8.0g NaOH为0.2mol,溶于水配成1L溶液,所得溶液浓度为0.2mol/L,体积1L为溶液的体积,不是溶剂的体积,故B错误;
C.阿伏加德罗常数个H2O分子的物质的量为1mol,标况下水不是气体,为液态,其体积远远小于22.4L,故C错误;
D.同温同压下,气体分子数目之比等于气体的体积之比,故标况下20mLNH3与60mLO2所含的分子个数比为20mL:60mL=1:3,故D正确,
故选D.
点评 本题考查气体摩尔体积、物质的量浓度、阿伏伽德罗定律及其推论,比较基础,侧重对基础知识的巩固,注意根据PV=nRT理解阿伏伽德罗定律及其推论.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | P4和NO2都是共价化合物 | |
| B. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 甲烷是对称的平面结构,所以是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图装置电解精炼铝 用图装置电解精炼铝 | |
| B. |  用图装置制备Fe(OH)2 用图装置制备Fe(OH)2 | |
| C. | 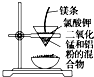 用图装置可制得金属锰 用图装置可制得金属锰 | |
| D. | 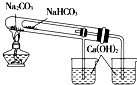 用图装置验证NaHCO3和Na2CO3的热稳定性 用图装置验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 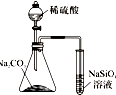 用图实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  用图实验可用于比较铝、铁的金属性的强弱 | |
| C. | 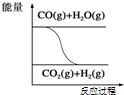 图表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 | |
| D. | 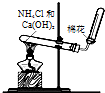 图装置可用于实验室制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
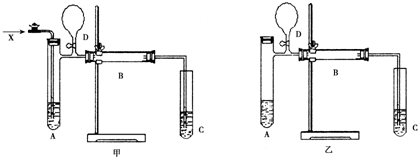
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
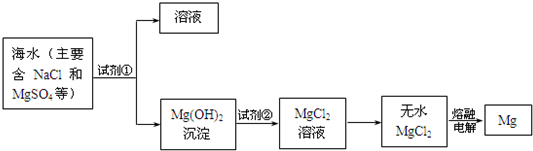
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:B>C>A | B. | 原子半径:B>A>C | ||
| C. | 对应气态氢化物的稳定性:A>C | D. | 还原性:Am->Cn- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com