
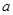 %和
%和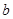 %的两种溶液,则
%的两种溶液,则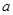 和
和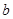 的关系是
的关系是A.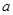 = =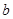 | B.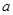 > >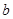 | C.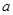 < <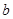 | D.无法确定 |
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3 |
| B.Na2O2、Na2CO3 |
| C.NaOH、Na2CO3 |
| D.Na2O2、NaOH、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5∶2 | B.2∶5 | C.2∶1 | D.1∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中的Na+总数不变 | B.溶液中溶质质量不变 |
| C.溶质的物质的量浓度不变 | D.溶液的质量不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
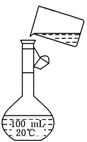

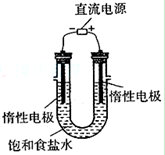
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。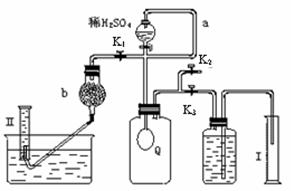
 _________________。
_________________。| A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ |
B.量筒Ⅱ读数时 ,量筒液面高于水槽液面 ,量筒液面高于水槽液面 |
| C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x |
| D.气体体积数值x、y没有扣除滴加的硫酸的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
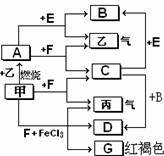
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 在电火花点火的情况下,两者恰好完全反应后恢复到原温度时,容器为真空且碳元素全部以正盐的形式存在,则CH4,O2,Na2O2的物质的量之比为 。
在电火花点火的情况下,两者恰好完全反应后恢复到原温度时,容器为真空且碳元素全部以正盐的形式存在,则CH4,O2,Na2O2的物质的量之比为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 两溶液中逐滴加入0.1 mol·L-1
两溶液中逐滴加入0.1 mol·L-1 的
的 盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间关系如图所示。
盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间关系如图所示。
 。其物质的量之比为 。
。其物质的量之比为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com