
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ △H>0。
CH3COO-+H+ △H>0。
(1) 下列方法中,可以使0.10 mol/L CH3COOH的电离程度增大的是_______(用序号填写)。
a.加入少量0.10 mol/L的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol/L d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液
(2) 将等质量的锌粒投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积关系为V(盐酸)_____V(醋酸)(填写“>”、“<”或“=").
(3)常温下,向体积为VamL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与Vb的关系为: Va______Vb(填写“>”、“<”或“=”)。
(4) 已知: 某温度时,水的离子积常数为Kw=1.0×10-12,在此温度下,将pH=1的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=_______mol/L。
【答案】 bcf < < 1.0×10-6
【解析】(1)a、加入少量0.10molL-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故a错误;b、醋酸的电离吸热,加热,促进醋酸的电离,则醋酸的电离程度增大,故b正确;c、加水稀释,促进醋酸的电离,则醋酸的电离程度增大,故c正确;d、加入少量冰醋酸,醋酸的浓度增大,电离平衡正向移动,但醋酸的电离程度降低,故d错误;e、加入少量氯化钠固体,不影响平衡的移动,故e错误;f、加入少量0.10molL-1的NaOH溶液,氢氧根离子和氢离子反应,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;故答案为:bcf;
(2)pH=3的醋酸与盐酸,氢离子浓度相同,但是醋酸是弱酸,溶液中存在大量未电离的醋酸分子,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以醋酸产生的氢气体积较大,故答案为:<;
(3)pH=3的醋酸溶液中,醋酸的浓度大于10-3mol/L,pH=11的NaOH溶液浓度等于10-3mol/L,最后溶液恰好呈中性,应加入碱的体积较小,如等体积的话,溶液呈酸性,所以Va<Vb,故答案为:Va<Vb;
(4)pH=1的盐酸中c(H+)=0.1mol/L,pH=11的NaOH溶液中c(OH-)= 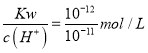 = 0.1mol/L,等体积混合后,溶液呈中性,故c(H+)=
= 0.1mol/L,等体积混合后,溶液呈中性,故c(H+)= ![]() =10-6mol/L;
=10-6mol/L;
故答案为:1.0×10-6;


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】2016年以来我国北方的“雾霾”污染日益严重。中科院“大气灰霾追因与控制”项目针对北京强霾过程进行分析,强霾过程中,出现了大量有毒有害的含氮有机颗粒物。燃煤和机动年尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②OCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
③H2O(g)=H2O(1)△H=-44.0kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________________________。
(2)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程中NO的物质的量随时间变化如下图所示。
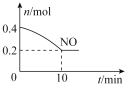
①写出该反应的化学方程式:________________________________。
②10min内该反应的速率v(N2)=___________;该反应达平衡时CO的转化率为___________;T℃时该化学反应的平衡常数K=___________。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是________。

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再改变
c.2v正(NO)=v逆(N2) d.气体的密度保持不变
(3)以燃料电池为代表的新能源的推广“使用能大大降低污染物的排放。如图是一种甲醚燃料电池结构,请写出该电池负极的电极反应式:________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①少量澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
A.一定没有CO2,肯定有H2
B.一定有CO、CO2和水蒸气
C.可能有CO2、NH3和水蒸气
D.一定有H2、CO2和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:

①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着各地“限牌”政策的推出,电动汽车成为汽车界的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图所示。其中 A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导 Li+的高分子材料,隔膜只允特定的离子通过,电池反应式为:LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法不正确的是( )
C6+LiCoO2。下列说法不正确的是( )
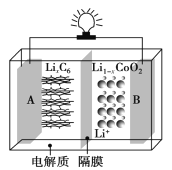
A. 该隔膜只允许 Li+通过,放电时 Li+从左边流向右边
B. 放电时,正极锂的化合价未发生改变
C. 充电时 B 作阳极,该电极放电时的电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2
D. 废旧钴酸锂(LiCoO2)电池进行“放电处理”让 Li+进入石墨中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=-36kJ·mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。

①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程II(填“大于”、“小于”或“等于”)。
II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,删得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,
在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。

(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
A.①③④ B.①②③④ C.①④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )

M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.将浓硫酸转移至容量瓶中,加水稀释至距标线2~3 cm处,改用胶头滴管定容
B.用酒精萃取碘水中的碘单质
C.进行液体蒸馏实验时,冷凝管中应充满自来水
D.某溶液加入盐酸酸化的氯化钡溶液后,出现白色沉淀,则原溶液中必有SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com