
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。

已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-
[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:____。
(2)过程II加入过量H2O2的作用是 ___ 。
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是_____。
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:_____。
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为____,得到的Fe2+再被O2氧化为FeOOH。
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。

已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:____,
第二步:____。
【答案】Fe2O3+6H+=2Fe3++3H2O 将Fe2+完全氧化为Fe3+,有利于与伯胺反应,提高萃取率 萃取、分液 Fe3++6Cl-![]() [FeCl6]3-(已知ii中的反应)使Fe3+浓度下降,3R-NH2+Fe3++SO42-+H2O
[FeCl6]3-(已知ii中的反应)使Fe3+浓度下降,3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+(已知i中的反应)平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取 4Fe3++5N2H4=4Fe2++N2+4N2H5+或4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl- Fe2O3+3H2O+6e-=2Fe+6OH- 2Fe+N2+3H2O= Fe2O3+2NH3
Fe(NH2-R)(OH)SO4+H+(已知i中的反应)平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取 4Fe3++5N2H4=4Fe2++N2+4N2H5+或4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl- Fe2O3+3H2O+6e-=2Fe+6OH- 2Fe+N2+3H2O= Fe2O3+2NH3
【解析】
粉煤灰主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质,加入硫酸酸浸,A12O3、Fe2O3、Fe3O4溶于硫酸生成硫酸铝、硫酸铁和硫酸亚铁,SiO2不溶,分离后,浸取液含有Al3+、Fe3+、Fe2+和SO42-等,在浸取液中先加入过量的H2O2将Fe2+全部氧化为Fe3+,再加入伯胺-煤油进行萃取,经分液得到水层和有机层,水层中含有Al3+,经后期处理得到金属铝。有机层为含有Fe(NH2-R)(OH)SO4的煤油层,向有机层中加入NaCl溶液经反萃取得到的水层中含有[FeCl6]3-,向水层2中加入N2H4将Fe3+还原为Fe2+,Fe2+再经氧化转化为FeOOH,煅烧FeOOH得到纳米Fe2O3,据此解答。
(1)根据以上分析,过程I中Fe2O3和硫酸反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)由信息可知,伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。所以过程II加入过量H2O2的作用是将Fe2+完全氧化为Fe3+,有利于与伯胺反应,提高萃取率,
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。所以过程II加入过量H2O2的作用是将Fe2+完全氧化为Fe3+,有利于与伯胺反应,提高萃取率,
故答案为:将Fe2+完全氧化为Fe3+,有利于与伯胺反应,提高萃取率;
(3) 过程II加入伯胺-煤油进行萃取,经分液得到水层和有机层,该分离操作为萃取、分液,
故答案为:萃取、分液;
(4) 有机层存在平衡:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+,过程III加入NaCl溶液发生:Fe3++6Cl-
Fe(NH2-R)(OH)SO4+H+,过程III加入NaCl溶液发生:Fe3++6Cl-![]() [FeCl6]3-反应,使Fe3+浓度下降,平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取,
[FeCl6]3-反应,使Fe3+浓度下降,平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取,
故答案为:Fe3++6Cl-![]() [FeCl6]3-(已知ii中的反应)使Fe3+浓度下降,3R-NH2+Fe3++SO42-+H2O
[FeCl6]3-(已知ii中的反应)使Fe3+浓度下降,3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H/span>+(已知i中的反应)平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取;
Fe(NH2-R)(OH)SO4+H/span>+(已知i中的反应)平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取;
(5)过量的N2H4将Fe3+转化为Fe2+并生成N2,根据得失电子守恒和电荷守恒及原子守恒,反应的离子方程式为4Fe3++5N2H4=4Fe2++N2+4N2H5+或4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-,
故答案为:4Fe3++5N2H4=4Fe2++N2+4N2H5+或4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-;
(6)由图可知,该电解装置中,阴阳极均为惰性电极,熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe,Fe与N2、水反应生成NH3和Fe2O3,Fe2O3在该过程中起催化作用,故反应分两步,第一步:Fe2O3+3H2O+6e-=2Fe+6OH-,第二步:2Fe+N2+3H2O= Fe2O3+2NH3,
故答案为:Fe2O3+3H2O+6e-=2Fe+6OH-;2Fe+N2+3H2O= Fe2O3+2NH3。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
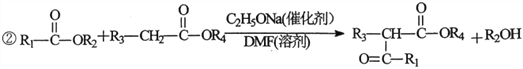
【题目】2一氧代环戊羧酸乙酯(K)是常见医药中间体,聚酯G是常见高分子材料,它们的合成路线如下图所示:
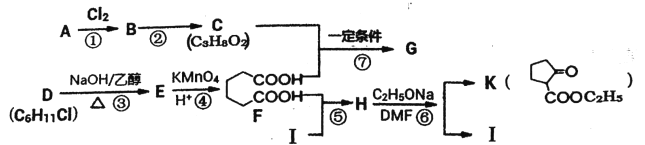
已知:①气态链烃A在标准状况下的密度为1.875g·L-1;
(1)B的名称为__________;E的结构简式为__________。
(2)下列有关K的说法正确的是__________。
A.易溶于水,难溶于CCl4
B.分子中五元环上碳原子均处于同一平面
C.能发生水解反应加成反应
D.1molK完全燃烧消耗9.5molO2
(3)⑥的反应类型为__________;⑦的化学方程式为__________
(4)与F官能团的种类和数目完全相同的同分异构体有__________种(不含立体结构),其中核磁共振氢谱为4组峰,且峰面积之比为1:2:3:4的是__________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料(其他无机试剂任选)制备![]()
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图,下列判断正确的是

A. 盐桥(琼脂-饱和KCl溶液)中的K+移向b烧杯溶液中
B. 烧杯b中发生的电极反应为Zn-2e- =Zn2+
C. 烧杯a中发生反应O2+4H+ +4e- =2H2O,溶液pH降低
D. 向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、铁、钴、铜等金属及其化合物在工业上有重要用途。请回答:
(1)基态铬原子的价电子排布图为___________。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为K2Cr2O2+3CCl4=2KCl +2CrO2Cl2+3COCl2↑。
①上述反应式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于__________晶体。
③配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配离子的化学式为___________。
(3)Co3+与NO2―形成的配合物与K+生成黄色沉淀检验溶液中的K+。配体NO2―的立体构型为__________,某常见气体化合物为NO2―的等电子体,该化合物的分子式为__________。
(4)氯和钾与+2价的铜可生成一种催化乙炔聚合反应的化合物,其阴离子为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为________杂化,这种化合物的化学式为_________

(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_____。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_____g/cm3(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。


下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是![]() +2H++e=NO2↑+H2O
+2H++e=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气处理存在反应:NO2(g)+CO(g)![]() NO(g)+CO2 (g),该反应过程及能量变化如图所示:
NO(g)+CO2 (g),该反应过程及能量变化如图所示:


下列说法正确的是
A. 升高温度,平衡正向移动
B. 该反应生成了具有非极性共价键的CO2
C. 使用催化剂可以有效提高反应物的平衡转化率
D. 反应物转化为活化络合物需要吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀。根据上述实验事实,下列说法中,不正确的是
A.溶解度 MnS<PbS
B.MnS存在沉淀溶解平衡 MnS(s)![]() Mn2+(aq) + S2-(aq)
Mn2+(aq) + S2-(aq)
C.Cu2+转化为沉淀的原理为 MnS(s) + Cu2+(aq)=CuS(s) + Mn2+(aq)
D.沉淀转化能用于除去溶液中的某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述能说明氯元素原子得电子能力比硫元素原子强的是( )
①![]() 的溶解度比
的溶解度比![]() 大 ②
大 ②![]() 的酸性比氢硫酸强 ③
的酸性比氢硫酸强 ③![]() 的稳定性比
的稳定性比![]() 强 ④
强 ④![]() 的还原性比
的还原性比![]() 强 ⑤
强 ⑤![]() 的酸性比
的酸性比![]() 强 ⑥
强 ⑥![]() 与铁反应生成
与铁反应生成![]() ,而
,而![]() 与铁反应生成
与铁反应生成![]() ⑦
⑦![]() 能与
能与![]() 反应生成
反应生成![]() ⑧在元素周期表中
⑧在元素周期表中![]() 处于
处于![]() 同周期的右侧 ⑨还原性:
同周期的右侧 ⑨还原性:![]()
A.③④⑤⑦⑧⑨B.③④⑥⑦⑧
C.③⑥⑦⑧⑨D.①②③④⑤⑥⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下8种物质:①熔融状态的NaCl、②NO2、③NaHCO3、④铜、⑤AgCl、⑥酒精、⑦稀H2SO4、⑧FeCl3溶液。
(1)上述物质中,属于电解质的是_________,能导电的是_________。(填序号)
(2)写出③溶于水的电离方程式:_________。
(3)写出④与⑧反应的离子方程式:_________。
(4)标准状况下,3.36L②完全溶于水配成500mL溶液,获得溶液物质的量浓度为_________,此过程中转移的电子数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com