
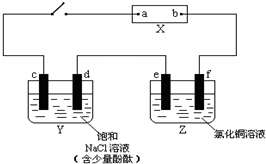
分析 (1)X为直流电源,Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒,接通电路后发现d附近显红色,则d附近生成OH-,则d极为电解池阴极,c、e为阳极,f为阴极,a为正极、b为负极;
串联电路中d、e分别为阴极、阳极,电子从e流向d;
(2)①Y槽中阳极上氯离子放电、阴极上水得电子生成氢气和氢氧根离子;
②e电极上Cu失电子生成铜离子;
(3)①e电极上溶解Cu、f极上析出Cu,电解2min后,取出e、f,洗净、烘干、称量,质量差为1.28g,实际上e电极上溶解0.64gCu,f电极上析出0.64gCu,根据溶解或析出Cu与转移电子之间的关系式计算转移电子物质的量;
②根据转移电子相等计算Y池中生成n(OH-),氢氧根离子浓度变化=$\frac{\frac{△n}{V}}{△t}$.
解答 解:(1)X为直流电源,Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒,接通电路后发现d附近显红色,则d附近生成OH-,则d极为电解池阴极,c、e为阳极,f为阴极,a为正极、b为负极;
串联电路中d、e分别为阴极、阳极,电子从e流向d;
①根据以上分析知,b为负极,故答案为:负;
②通过以上分析知,e为阳极,故答案为:阳;
③根据以上分析知,电子流向为d←e,故答案为:←;
((2)①Y槽中阳极上氯离子放电、阴极上水得电子生成氢气和氢氧根离子,电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
②e电极上Cu失电子生成铜离子,电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
(3)①e电极上溶解Cu、f极上析出Cu,电解2min后,取出e、f,洗净、烘干、称量,质量差为1.28g,实际上e电极上溶解0.64gCu,f电极上析出0.64gCu,根据溶解或析出Cu与转移电子之间的关系式得转移电子物质的量=$\frac{0.64g}{64g/mol}×2$=0.02mol,故答案为:0.02;
②串联电路中转移电子相等,根据2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑知,当转移0.02mol电子时,
Y池中生成n(OH-)=$\frac{0.02mol}{2}×2$=0.02mol,氢氧根离子浓度变化=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.02mol}{0.5L}}{2min}$=0.02mol/(L.min),
故答案为:0.02.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,正确判断各个电极名称、各个电极上发生的反应是解本题关键,易错点是(3)①的计算,注意:电解一段时间后两个电极质量差实际上等于阳极溶解的Cu和阴极析出的Cu质量之和,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 ,F
,F ,AB2
,AB2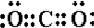 ,A的最简单气态氢化物
,A的最简单气态氢化物 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
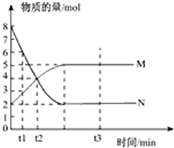 一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成上相差一个或若干个CH2原子团的有机物一定是同系物 | |
| B. | 具有相同的通式且相差一个或若干个CH2原子团的有机物一定是同系物 | |
| C. | 互为同系物的有机物分子结构必然相似 | |
| D. | 互为同系物的有机物通式不一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳能使漂白粉水溶液先变浑浊后变澄清,二氧化硫也有同样现象 | |
| B. | 加热条件下,钠与氧气反应生成过氧化钠,锂与氧气反应也生成过氧化锂 | |
| C. | 常温下,浓硝酸能使铁、铝钝化,浓硫酸也能使铁、铝钝化 | |
| D. | 铁可置换出硫酸铜溶液中的铜,钠也可置换出硫酸铜溶液中的铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com