
【题目】在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g) ![]() 2C(g);△H<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);△H<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
X | Y | |
A | 再加入A | B的百分含量 |
B | 再加入C | A的体积分数 |
C | 增大压强 | A的转化率 |
D | 升高高温度 | 混合气体平均摩尔质量 |
A. A B. B C. C D. D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验的操作正确的是( )
实验 | 操作 | |
① | 验证淀粉已完全水解 | 向水解产物中加入新制的Cu(OH) 2 悬浊液,加热 |
② | 比较氯和硅的非金属性强弱 | 将盐酸滴入Na2SiO3溶液中 |
③ | 验证Na2SO3 已被氧化 | 取样品溶于水,先加足量盐酸酸化,然后再加BaCl2 溶液 |
④ | 比较水和乙醇中羟基氢的活泼性 | 颗粒大小相同的钠分别与水和乙醇反应 |
⑤ | 除去乙酸乙酯中的乙酸、乙醇 | 加入足量饱和Na2CO3溶液,振荡、静置分液 |
⑥ | 验证用稀硝酸能将Fe 氧化成Fe3 + | 稀硝酸加入过量铁粉中,充分反应后滴加KSCN 溶液 |
A. ③ ④ ⑤ B. ① ② ⑥ C. ③ ⑤ ⑥ D. ① ③ ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由氯化铵制取氯气的工艺原理如下:
反应Ⅰ.2NH4Cl+MgO![]() 2NH3↑+MgCl2+H2O↑
2NH3↑+MgCl2+H2O↑
反应Ⅱ.2MgCl2+O2![]() 2MgO+2Cl2
2MgO+2Cl2
下列说法正确的是
A. 该工艺中MgO可循环利用
B. 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L
C. 在800~1000℃条件下,O2的还原性强于Cl2的还原性
D. 若反应2NH3+MgCl2+H2O=2NH4Cl+MgO能自发进行,则该反应ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O22-代替(如图),晶体中含有的哑铃形O22-使晶胞沿一个方向拉长。下列对于KO2晶体结构的描述正确的是( )

A. 与K+距离最近且相等的O2-共有4个 B. KO2的熔点比RbO2的熔点低
C. 与K+距离最近且相等的K+有12个 D. 一个KO2晶胞的质量为284 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )

A. a点时溶液中存在c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. 0~a段溶液中水电离出的OH-浓度先增大后减小
C. a=0.2
D. ab段发生反应的离子方程式为CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 12g石墨中含有C-C键的个数为1.5NA B. 60g SiO2中含有Si-O键的个数为2NA
C. 124 g P4中含P-P键的个数为4 NA D. 12 g金刚石中含C-C键的个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJmol-1
②N2(g)+O2(g)![]() 2NO(g) △H=+180.5kJmol-1
2NO(g) △H=+180.5kJmol-1
③4NO(g)+6H2O(g)![]() 4NH3(g)+5O2(g) △H=+l025kJmol-1
4NH3(g)+5O2(g) △H=+l025kJmol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g) △H =-92.4kJmol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJmol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3 从高到低的顺序是_________________;测得B(X,60)点时N2的转化率为50%,则X=________。
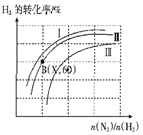
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com