
【题目】在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是:____________。
(2)硅与铝同周期.地壳里硅铝的含量硅____________铝(填>,<或=)。工业上制备金属铝的化学方程式是: ____________,工业上制备硅的化学方程式有:
a.SiO2+2C![]() Si(粗)+2CO
Si(粗)+2CO
b.SiO2+3C![]() SiC +2CO(副反应),
SiC +2CO(副反应),
c.Si(粗)+ 2C12![]() SiCl4
SiCl4
d.SiC14 + 2H2![]() Si+4HC1,
Si+4HC1,
某同学将氧化还原反应、非氧化还原反应及四大基本反应绘制成上图,其中属于上图“2"区域的反应是____________ (填序号)。

(3)SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2OCaO6SiO2,钠长石(NaAlSi3O8)的氧化物形式____________,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同.由此可推知钙长石的化学式为____________。
(4)某铝合金由Al、Si、Cu、Mg组成。①称取100g该铝合金样品,分成等质量的A、B两份。向A 份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下)。则样品中Si和Mg的物质的量分别是n(Si)____________和n(Mg)____________。
【答案】(1)铺上一层KClO3粉末,点燃插入的镁条;(2)>;Al2O3![]() 4 Al+3O2↑;b;
4 Al+3O2↑;b;
(3) Na2OAl2O36SiO2;CaAl2Si2O8; (4)0.4mol;0.6mol
【解析】
试题分析:(1)氧化铁和铝在高温下发生铝热反应生成氧化铝和铁,反应的化学方程式为Fe2O3+2Al![]() 2Fe+Al2O3,为使反应顺利进行,可加入氯酸钾,为助燃剂,点燃镁时反应放出大量的热,镁为引燃剂,所以引发铝热反应的实验操作是加少量KClO3,插上镁条并将其点燃,故答案为:铺上一层KClO3粉末,点燃插入的镁条;
2Fe+Al2O3,为使反应顺利进行,可加入氯酸钾,为助燃剂,点燃镁时反应放出大量的热,镁为引燃剂,所以引发铝热反应的实验操作是加少量KClO3,插上镁条并将其点燃,故答案为:铺上一层KClO3粉末,点燃插入的镁条;
(2)地壳中含量排在前五位的元素分别是:O、Si、Al、Fe、Ca,地壳里硅铝的含量硅大于铝;工业上通过电解氧化铝冶炼金属铝,反应的化学方程式为,Al2O3![]() 4 Al+3O2↑;图中“2"区域表示该反应属于氧化还原反应,但不属于四类基本反应,a.SiO2+2C
4 Al+3O2↑;图中“2"区域表示该反应属于氧化还原反应,但不属于四类基本反应,a.SiO2+2C![]() Si(粗)+2CO属于置换反应,是四类基本反应,错误;b.SiO2+3C
Si(粗)+2CO属于置换反应,是四类基本反应,错误;b.SiO2+3C![]() SiC +2CO(副反应),属于氧化还原反应,但不属于四类基本反应,正确;c.Si(粗)+ 2C12
SiC +2CO(副反应),属于氧化还原反应,但不属于四类基本反应,正确;c.Si(粗)+ 2C12![]() SiCl4,属于化合反应,是四类基本反应,错误;d.SiC14 + 2H2
SiCl4,属于化合反应,是四类基本反应,错误;d.SiC14 + 2H2![]() Si+4HC1,属于置换反应,是四类基本反应,错误;故选b;故答案为:>;Al2O3
Si+4HC1,属于置换反应,是四类基本反应,错误;故选b;故答案为:>;Al2O3![]() 4 Al+3O2↑;b;
4 Al+3O2↑;b;
(3)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMOnSiO2mH2O),钠长石(NaAlSi3O8)的碱性氧化物Na2O、两性氧化物Al2O3、酸性氧化物SiO2,因此钠长石的氧化物形式为:Na2OAl2O36SiO2;结合钠长石的化学式可知钙长石就是将钠长石的中钠更换为钙,以及化合物中化合价代数和等于0可得钙长石,其氧化物形式为:CaOAl2O32SiO2,化学式为CaAl2Si2O8,故答案为:>;Na2OAl2O36SiO2;CaAl2Si2O8;
(4)A份中Al、Si与氢氧化钠溶液反应,B份中Al、Mg与盐酸反应,A份和B份中Al反应放出的气体相等,因此两份气体差和质量差均来源于Mg、Si,Si、Mg与生成氢气的物质的量关系为:Si~2H2、Mg~H2,标准状况下2240mL气体的物质的量为![]() =0.1mol,设A份中含有的Si的物质的量为xmol,B份中含有Mg的物质的量为ymol,由质量差可得:①24y-28x=1.6
=0.1mol,设A份中含有的Si的物质的量为xmol,B份中含有Mg的物质的量为ymol,由质量差可得:①24y-28x=1.6
由气体相差0.1mol可得:②2x-y=0.1,
联立求得:x=0.2,y=0.3,则样品中Si和Mg的物质的量分别0.4mol、0.6mol,
故答案为:0.4mol;0.6mol


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.请回答:
(1)MgCl2的电子式 。
(2)除去铜粉中少量铁粉不用稀硝酸,用化学方程式表示其原因 。
(3)往饱和Na2CO3溶液中通入CO2气体,溶液中出现白色浑浊,写出该反应的离子方程式 。
(4)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:
( )MnO4-+( )H2O2+ =( )Mn2++( )H2O+ 。
Ⅱ.无机化合物A 和NaH都是重要的还原剂,遇水都强烈反应。一定条件下,2.40g NaH与气体B反应生成3.90g化合物A和 2.24L(已折算成标准状况)的H2。已知气体B可使湿润红色石蕊试纸变蓝。
请回答下列问题:
(1)A的化学式是 。
(2)NaH与气体B反应生成化合物A的化学方程式 。
(3)A与足量盐酸发生非氧化还原反应的化学方程式 。
(4)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
(5)某同学认为:用足量B的水溶液吸收工业制硫酸尾气中的SO2,“吸收液”通过蒸发结晶制得的固体即为纯净的亚硫酸盐;取少量该固体加水溶解,再加入过量BaCl2溶液,若产生白色沉淀,即可证明得到的固体一定是纯净物。
判断该同学设想的制备和验纯方法的合理性并说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。G单质是日常生活中用量最大的金属,易被腐蚀。
试回答下列问题:
(1)A元素的同位素有___________(写原子符号)
(2)实验室制取B的简单氢化物的化学反应方程式为_________________________
(3)C、D、E、F的简单离子半径由大到小的顺序是_________________(用离子符号表示)
(4)用化学事实说名E与F这两种元素非金属性的强弱_____________________(举一例)
(5)下列有关G的说法不正确的是_______
A、铁位于第四周期ⅧB族,在人体内的血红蛋白中含有铁元素
B、过量的铁分别与氯气和稀盐酸反应所得氯化物相同
C、FeCl3、FeCl2、Fe(OH)3都可以通过化合反应制取
D、氢氧化铁与HI溶液仅发生中和反应
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示。请写出t2时反应的总的化学方程式 _____________________ 。
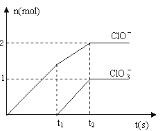
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,回答下列问题:

(1)写出元素符号:①__________,⑧__________,⑩__________。
(2)若用R代表碱金属元素,则其最高价氧化物对应的水化物的化学式为__________;若用X表示卤族元素,则其气态氢化物的分子式为 ;写出元素①的简单气态氢化物的电子式:
(3)元素②、⑧、B的气态氢化物的稳定性由强到弱的顺序为______________________________(填化学式)。
(4)写出单质⑤在溶于强碱(NaOH)溶液的离子方程式: 。
(5)在元素③、④、⑤中,化学性质较活泼的是 (填元素符号),写出证明它较活泼的实验方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )

A. PbO2是电池的负极
B. SO42-向Pb极移动
C. PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于等质量的14CO2与N218O的说法不正确的是
A.分子数之比为1 : 1 B.原子数之比为1:1
C.密度之比为1 : 1 D.中子数之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com