
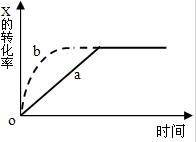
 图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 使用催化剂 | D. | 缩小体积 |
分析 由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,以此解答该题.
解答 解:由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,
A.该反应正反应是放热反应,升高温度,反应速率加快,平衡向逆反应移动,x的转化率降低,故A错误;
B.加大X的投入量,X浓度增大,反应速率加快,平衡向正反应移动,但x的转化率降低,故B错误;
C.加入催化剂,反应速率加快,催化剂不影响平衡移动,x的转化率不变,故C正确;
D.N为固体,缩小体积,平衡正向移动,X的转化率增大,故D错误.
故选C.
点评 本题考查化学平衡移动图象与影响因素,为高频考点,侧重于学生的分析能量的考查,难度中等,根据曲线变化分析条件改变对速率、X转化率的影响是解题的关键,注意对平衡移动原理的理解.


科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1LpH=2的HCl溶液中,由水电离出的H+的数目0.01NA | |
| B. | 标准状况下,2.24L的CCl4中含有的氯原子数为0.4NA | |
| C. | 常温下,1molCO2中含有的共用电子对数目为2NA | |
| D. | 标准状况下,2.24L Cl2与水充分反应,转移的电子数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
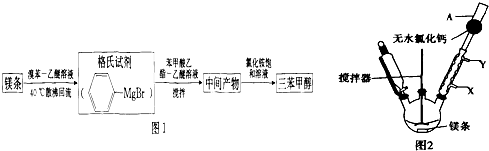
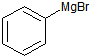 +H2O→
+H2O→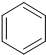 +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
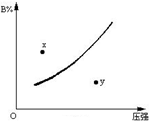 反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | m+n>P | |
| B. | n>p | |
| C. | x点表示该反应的正反应速率小于逆反应速率 | |
| D. | x点比y点时的反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:
连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
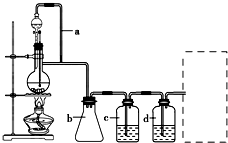 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000mL 2.5mol/L NaCl 溶液 | B. | 300mL 5mol/L KClO3溶液 | ||
| C. | 250mL 1mol/L AlCl3溶液 | D. | 200mL 2mol/L MgCl2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com